题目内容
11.病人输液用的葡萄糖注射液是葡萄塘(C6H12O6)的水溶液,其瓶上标签的部分内容如图所示,
请利用标签所提供的信息,回答下列问题:
(1)葡萄糖的相对分子质量为180摩尔质量为180g/mol
(2)一瓶该注射液中含有葡萄糖的质量为25g,该注射液中葡萄糖的物质的量浓度为0.28mol/L(保留两位小数)
(3)该注射液中,葡萄糖与水的分子个数之比N(C6H12O6):N(H2O)=1:230,(保留最简整数比),该注射液中氢元素与氧元素的质量之比m(H):m(O)=1:8(保留最简整数比).
分析 (1)根据葡萄塘的分子式C6H12O6计算其相对分子质量、摩尔质量;
(2)根据该葡萄糖溶液的密度及、体积及质量分数计算含有葡萄糖的质量;根据c=$\frac{1000ρω}{M}$计算出该葡萄糖溶液的浓度;
(3)分子数之比等于其物质的量之比,根据溶液质量、葡萄糖的质量计算出水的质量,再根据n=$\frac{m}{M}$计算出葡萄糖和水的物质的量之比即可;根据N(C6H12O6):N(H2O)的比值计算出该注射液中氢元素与氧元素的质量之比.
解答 解:(1)葡萄塘的分子式为C6H12O6,则其相对分子质量为180,摩尔质量为180g/mol,故答案为:180;180g/mol;
(2)该葡萄糖溶液的体积为500mL、质量分数为5%、密度为1g•cm3,则一瓶该注射液中含有葡萄糖的质量为:1g•cm3×500mL×5%=25g;
该葡萄糖溶液的物质的量浓度为:c=$\frac{1000×1×5%}{180}$mol/L=0.28mol/L,
故答案为:25g;0.28mol/L;
(3)该葡萄糖溶液中含有25g葡萄糖,其物质的量为:n=$\frac{25g}{180g/mol}$=$\frac{5}{36}$mol,
该葡萄糖注射液中含有水的物质的量为:$\frac{1g/mL×500mL-25g}{18g/mol}$=$\frac{575}{18}$mol,
葡萄糖与水的分子个数之比N(C6H12O6):N(H2O)=n(C6H12O6):n(H2O)=$\frac{5}{36}$mol:$\frac{575}{18}$mol=1:230;
由于葡萄糖(C6H12O6)和(H2O)分子中H、O原子数之比为2:1,
则该注射液中氢元素与氧元素的质量之比m(H):m(O)=1×2:16=1:8,
故答案为:1:230;1:8.
点评 本题考查了物质的量浓度的计算,题目难度中等,明确物质的量与物质的量浓度、摩尔质量之间的关系为解答关键,注意掌握物质的量浓度与溶质质量分数的关系,试题培养了学生的化学计算能力.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案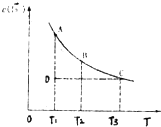 已知,I2(aq)+I-(aq)?I3-(aq).某I2、KI溶液中,c(I3-)与温度(T)的关系如图所示(曲线上任何一点都表示平衡状态).下列说法正确的是( )
已知,I2(aq)+I-(aq)?I3-(aq).某I2、KI溶液中,c(I3-)与温度(T)的关系如图所示(曲线上任何一点都表示平衡状态).下列说法正确的是( )| A. | 反应I2(aq)+I-(aq)?I3-(aq)△H>0 | |
| B. | 状态A的c (I2)比状态D的小 | |
| C. | A点对应的反应速率大于C点对应的反应速率 | |
| D. | 其他条件不变,向溶液中加入KI固体,平衡由C点移动到D点 |
| A. | 28g氮气所含有的原子数目为NA | |
| B. | 标准状况下,22.4L水中含有NA个水分子 | |
| C. | 标准状况下,22.4L氯化氢所含的原子数为NA | |
| D. | 化学反应中1mol金属镁变成镁离子时失去电子数目为2NA |
| A. | 活泼金属必须保存在石蜡或煤油中 | |
| B. | 取用后剩余的化学药品一定要放入废液缸中 | |
| C. | 用稀硫酸代替稀盐酸洗净做焰色反应的铁丝 | |
| D. | 实验室Na失火用干沙灭火 |
| A. | SO2 SO3 | B. | CO CO2 | C. | Na2O Na2O2 | D. | O2 O3 |
| A. | 青石棉是一种硅酸盐材料 | |
| B. | 青石棉的化学组成可表示为Na2O•3FeO•Fe2O3•8SiO2•H2O | |
| C. | 1 mol青石棉中含有8 mol SiO2 | |
| D. | 1 mol青石棉能还原1 mol HNO3的稀硝酸 |
| A. | 用CO2合成可降解的聚碳酸酯塑料,可以实现“碳”的循环利用 | |
| B. | 开发利用太阳能、生物质能等清洁能源,有利于节约资源 | |
| C. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| D. | 制备物质时探究化学反应中高的选择性、转化率和原子利用率,属于“绿色”的生产工艺 |
| A. | X与Z均只能形成一种氧化物 | |
| B. | 离子半径r(Y)<r(Z) | |
| C. | W的最高价氧化物对应的水化物是强酸 | |
| D. | Y的气态氢化物的热稳定性比W的弱 |
 保持营养平衡、科学使用食品添加剂并合理使用药物,有助于健康和提高人体自身免疫力.
保持营养平衡、科学使用食品添加剂并合理使用药物,有助于健康和提高人体自身免疫力.