题目内容
19.一种三室微生物燃料电池污水净化系统原理如图所示,图中含酚废水中有机物可用C6H5OH表示,左、中、右室间分别以离子交换膜分隔.下列说法不正确的是( )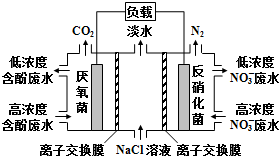
| A. | 右室电极为该电池的正极 | |
| B. | 左室电极反应式可表示为:C6H5OH-28e-+11H2O═6CO2↑+28H+ | |
| C. | 右室电极附近溶液的pH减小 | |
| D. | 工作时中间室的Cl-移向左室,Na+移向右室 |
分析 该原电池中,硝酸根离子得电子发生还原反应,则右边装置中电极是正极,电极反应式为2NO3-+10e-+12H+=N2↑+6H2O,左边装置电极是负极,负极上有机物失电子发生氧化反应,有机物在厌氧菌作用下生成二氧化碳,电极反应式为C6H5OH-28e-+11H2O═6CO2↑+28H+,据此分析解答.
解答 解:该原电池中,硝酸根离子得电子发生还原反应,则右边装置中电极b是正极,电极反应式为2NO3-+10e-+12H+=N2↑+6H2O,左边装置电极a是负极,负极上有机物失电子发生氧化反应,有机物在厌氧菌作用下生成二氧化碳,电极反应式为C6H5OH-28e-+11H2O═6CO2↑+28H+,
A.该原电池中,硝酸根离子得电子发生还原反应,则右边装置中电极是正极,故A正确;
B.左边装置电极是负极,负极上有机物失电子发生氧化反应,有机物在厌氧菌作用下生成二氧化碳,电极反应式为C6H5OH-28e-+11H2O═6CO2↑+28H+,故B正确;
C.右边装置中电极是正极,电极反应式为2NO3-+10e-+12H+=N2↑+6H2O,氢离子参加反应导致溶液酸性减小,溶液的pH增大,故C错误;
D.放电时,电解质溶液中阳离子Na+移向正极右室,阴离子Cl-移向负极室左室,故D正确;
故选C.
点评 本题考查化学电源新型电池,题目难度中等,侧重考查学生获取信息、分析推断能力,根据N元素化合价变化确定正负极,难点是电极反应式的书写,且原电池和电解池原理是高考高频点,要熟练掌握.

练习册系列答案
相关题目
9.下列操作不正确的是( )
| A. | 配制氯化铁溶液时需加入少量盐酸 | |
| B. | 金属钠保存在装有煤油的带玻璃塞的广口瓶中 | |
| C. | 保存液溴需用水封,放在带橡皮塞子的棕色细口瓶中 | |
| D. | 用稀硝酸洗去附在试管内壁的银镜 |
10.下列有关说法正确的是( )
| A. | 同周期金属元素的化合价越高,元素的金属性越强 | |
| B. | 海轮外壳上附着一些锌块,可以减缓海轮外壳的腐蚀 | |
| C. | 在含有 BaSO4 沉淀的溶液中加入 Na2SO4固体,c(Ba2+) 增大 | |
| D. | 2NO(g)+2CO(g)═N2(g)+2CO2(g) 在常温下能自发进行,则该反应的△H>0 |
7.下列有关实验原理、操作及安全知识的叙述,正确的是( )
| A. | 不慎将苯酚固体粉末沾在皮肤上,立即用大量热水(>65℃)冲洗 | |
| B. | 银氨溶液、Cu(OH)2悬浊液、氯水在实验室里均不宜长期放置 | |
| C. | 检验C2H5Cl中的氯元素:将C2H5Cl与NaOH溶液混合加热,冷却后加AgNO3溶液 | |
| D. | 同温下用pH试纸测定等浓度的NaClO溶液和CH3COONa溶液的pH,可以证明HClO和CH3COOH的酸性强弱 |
14.在1.0L密闭容器中放入0.10molA(g),在一定温度进行如下反应:
A(g)?2B(g)+C(g)+D(s)△H=+85.1kJ•mol-1
容器内气体总压强(P)与起始压强P0的比值随反应时间(t)数据见下表:
回答下列问题:
(1)下列操作能提高A转化率的是AD
A.升高温度 B.体系中通入A气体
C.通入稀有气体He,使体系压强增大到原来的5倍
D.若体系中的C为HCl,其它物质均难溶于水,滴入少许水
(2)该反应的平衡常数的表达式K=$\frac{{c}^{2}(B)×c(C)}{c(A)}$,前2小时C的反应速率是0.02 mol•L-1•h-1
(3)平衡时A的转化率为70%.
A(g)?2B(g)+C(g)+D(s)△H=+85.1kJ•mol-1
容器内气体总压强(P)与起始压强P0的比值随反应时间(t)数据见下表:
| 时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 |
| $\frac{P}{{P}_{0}}$ | 1.00 | 1.50 | 1.80 | 2.20 | 2.30 | 2.38 | 2.40 | 2.40 |
(1)下列操作能提高A转化率的是AD
A.升高温度 B.体系中通入A气体
C.通入稀有气体He,使体系压强增大到原来的5倍
D.若体系中的C为HCl,其它物质均难溶于水,滴入少许水
(2)该反应的平衡常数的表达式K=$\frac{{c}^{2}(B)×c(C)}{c(A)}$,前2小时C的反应速率是0.02 mol•L-1•h-1
(3)平衡时A的转化率为70%.
4.汽车已经进入千家万户,汽油来自于石油化工.下列说法不正确的是( )
| A. | 石油中含有1~50个碳原子的烷烃及环烷烃 | |
| B. | 石油分馏是物理变化,裂化、裂解和催化重整属于化学变化 | |
| C. | 石油裂化的目的主要是提高汽油的产量 | |
| D. | 裂化主要是将链烃变为芳香烃 |
11.为了鉴定溴乙烷中溴元素的存在,试分析下列各步实验:①加入AgNO3溶液 ②加入NaOH溶液 ③加热 ④用稀HNO3酸化溶液,其中操作顺序合理的是( )
| A. | ①②③④ | B. | ②③④① | C. | ④③②① | D. | ②③①④ |
8.苯(C6H6)与无机苯(B3N3H6)具有相似的结构和性质,如图所示,则其二氯取代物的异构体数相比,下列说法正确的是( )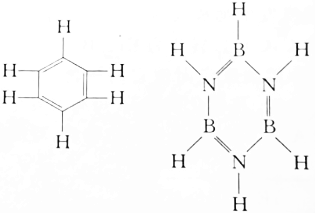

| A. | 前者大于后者 | B. | 前者等于后者 | C. | 前者小于后者 | D. | 无法确定 |
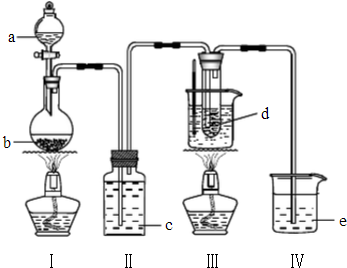 氯气与碱溶液反应时,在低温和稀碱溶液中主要产物是ClO-和Cl-,在75℃以上和浓碱溶液中主要产物是ClO-和Cl-.研究小组用以下实验装置制取氯酸钾(KClO3)并测定溶度.
氯气与碱溶液反应时,在低温和稀碱溶液中主要产物是ClO-和Cl-,在75℃以上和浓碱溶液中主要产物是ClO-和Cl-.研究小组用以下实验装置制取氯酸钾(KClO3)并测定溶度.