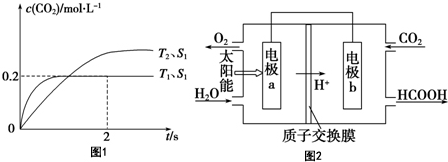
题目内容
15.如图是一些常见的单质、化合物之间的转化关系图,有些反应中的部分物质被略去.常温常压下,A为无色有毒气体,B为红棕色粉末,C、E为金属单质.反应①②均为工业上的重要反应.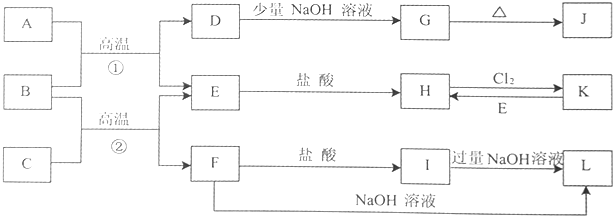
(1)反应②的化学方程式为2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe.
(2)G→J的化学方程式为2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O.
(3)K→H的离子方程式为2Fe3++Fe=3Fe2+.
分析 B为红棕色粉末,则B为Fe2O3,A为无色有毒气体,结合转化关系,可推知A具有还原性,故A为CO,则D为CO2,E为Fe,G为NaHCO3,J为Na2CO3,H是FeCl2,K为FeCl3,金属C与氧化铁反应生成Fe与F,F为金属氧化物,既与盐酸反应又能与氢氧化钠反应,则F为Al2O3,C是Al,I为AlCl3,L为NaAlO2,据此解答.
解答 解:B为红棕色粉末,则B为Fe2O3,A为无色有毒气体,结合转化关系,可推知A具有还原性,故A为CO,则D为CO2,E为Fe,G为NaHCO3,J为Na2CO3,H是FeCl2,K为FeCl3,金属C与氧化铁反应生成Fe与F,F为金属氧化物,既与盐酸反应又能与氢氧化钠反应,则F为Al2O3,C是Al,I为AlCl3,L为NaAlO2.
(1)反应②的化学方程式为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe,
故答案为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe;
(2)G→J的化学方程式为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,
故答案为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O;
(3)K→H的离子方程式为:2Fe3++Fe=3Fe2+,
故答案为:2Fe3++Fe=3Fe2+.
点评 本题考查无机物的推断,B的颜色、A的性质及转化中F的性质为推断突破口,注意对基础知识的理解掌握.

练习册系列答案
相关题目
5.SO2既有氧化性又有还原性,通常以还原性为主,Fe3+和Cr2O72-具有氧化性.将SO2与足量Fe2(SO4)3溶液完全反应后,再加入K2Cr2O7溶液,前后依次发生两个氧化还原反应.据此下列有关说法正确的是( )
| A. | 还原性:Cr3+>Fe2+>SO2 | |
| B. | 氧化性:Cr2O72->SO2>Fe3+ | |
| C. | 足量的SO2也不能使Fe2(SO4)3溶液完全褪去颜色 | |
| D. | Fe2(SO4)3在前一个反应中做氧化剂,后一个反应中做还原剂 |
6.环境保护是当今倍受人们关注的社会问题.下列叙述不正确的是( )
| A. | 二氧化硫会形成酸雨 | |
| B. | 氮氧化物会形成光化学烟雾 | |
| C. | 过度使用煤作能源会引起雾霾等环境危害 | |
| D. | 一氧化碳是造成温室效应的主要物质 |
3.“宽带中国”战略的阶段性发展目标指出,2015年要基本实现城市光纤到楼入户、农村宽带进乡入村,光纤到户(FTTH)要达0.7亿用户.光纤(光导纤维的简称)的主要成分是( )
| A. | 晶体硅 | B. | 二氧化硅 | C. | 硅酸钠 | D. | 铝硅合金 |
10.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 常温常压下,2gH2含有的氢原子数目为2NA | |
| B. | 标准状况下,22.4LCCl4中含有的分子数为NA | |
| C. | 标准状况下,20gD2O中含有的电子数为10NA | |
| D. | 常温常压下,1mol•L-1K2CO3溶液中含有的钾离子数目为2NA |
7.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,22.4L D2中所含中子数为2NA | |
| B. | 1 molCO2与1L 2mol/L的NaOH溶液反应后,溶液中的CO32-数为0.5 NA | |
| C. | 6.8g熔融的KHSO4中含有0.1NA个阳离子 | |
| D. | 3.36L氯气与2.7g铝充分反应,转移电子数一定为0.3NA |
13.下列说法一定正确的是( )
| A. | 反应A(s)?2B(g)+C(g),当C的体积分数不变时,反应达到平衡状态 | |
| B. | 将钢闸门与直流电源的正极相连,可防止钢闸门腐蚀 | |
| C. | 用FeS为沉淀剂除去废水中的Hg2+:FeS(s)+Hg2+(aq)═HgS(s)+Fe2+(aq) | |
| D. | 增大反应物浓度可加快反应速率,因此可用浓硫酸与铁反应增大生成氢气的速率 |
 科学家研究发现金属离子吸收氧气的能力十分巨大,人体血液中的血红蛋白依靠亚铁离子结合氧气,其他金属离子(Cu2+、Zn2+等)也可以实现结合和运输氧气的目的.最近丹麦科学家研发了一种晶体材料,该晶体吸收氧气的能力依靠钴离子,它可以让人在水下持久地获得氧气.
科学家研究发现金属离子吸收氧气的能力十分巨大,人体血液中的血红蛋白依靠亚铁离子结合氧气,其他金属离子(Cu2+、Zn2+等)也可以实现结合和运输氧气的目的.最近丹麦科学家研发了一种晶体材料,该晶体吸收氧气的能力依靠钴离子,它可以让人在水下持久地获得氧气.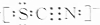 ,则SCN-中σ 键与π键的个数比为1:1.
,则SCN-中σ 键与π键的个数比为1:1.