题目内容
质量相等的N2O4和NO2两种气体中,分子数之比为 ,氮原子的物质的量之比为 ,氧元素的质量比为 .
考点:物质的量的相关计算
专题:计算题
分析:令N2O4和NO2的质量为1g,根据n=
计算N2O4和NO2的物质的量,分子数目之比等于物质的量之比,计算N原子物质的量,进而计算氮原子物质的量之比,根据m=nM计算氧元素质量之比.
| m |
| M |
解答:
解:令N2O4和NO2的质量为1g,则N2O4的物质的量=
=
mol,NO2的物质的量=
=
mol,分子数目之比等于物质的量之比=
mol:
mol=1:2,N原子物质的量之比=
mol×2:
mol=1:1,氧元素质量之比=
mol×4×16g/mol:
mol×2×16g/mol=1:1,
故答案为:1:2;1:1;1:1.
| 1g |
| 92g/mo |
| 1 |
| 92 |
| 1g |
| 46g/mol |
| 1 |
| 46 |
| 1 |
| 92 |
| 1 |
| 46 |
| 1 |
| 92 |
| 1 |
| 46 |
| 1 |
| 92 |
| 1 |
| 46 |
故答案为:1:2;1:1;1:1.
点评:本题考查物质的量有关计算,比较基础,注意对公式的理解与灵活应用,有利于基础知识的巩固.

练习册系列答案
相关题目
下列离子方程式书写正确的是( )
| A、明矾溶液中加入过量的氨水A13++4NH3?H2O=AlO2-+4NH4++2H2O |
| B、乙酸溶液中加入少量碳酸氢铵溶液CH3COOH十HCO3-=CH3COO-+CO2↑+H2O |
| C、在FeI2溶液中滴入少量溴水2Fe2++4I-+3Br2=2Fe3++2I2+6Br- |
| D、碳酸钠溶液中逐滴加入与之等物质的量的盐酸:CO32-+2H+=CO2↑+H2O |
精制食盐水时下列物质中,不必用到的有( )
①NaOH溶液 ②盐酸 ③K2CO3溶液 ④BaCl2溶液 ⑤硫酸 ⑥Na2CO3溶液 ⑦Ba(NO3)2溶液.
①NaOH溶液 ②盐酸 ③K2CO3溶液 ④BaCl2溶液 ⑤硫酸 ⑥Na2CO3溶液 ⑦Ba(NO3)2溶液.
| A、③④⑤ | B、③⑤⑦ |
| C、②⑤⑥ | D、②④⑤⑦ |
既与稀HCl反应,又与NaOH溶液反应的是( )
| A、Mg | B、Al | C、Fe | D、Cu |
 表代表周期表中的几种短周期元素,下列说法中错误的是( )
表代表周期表中的几种短周期元素,下列说法中错误的是( )| A、C、D气态氢化物稳定性强弱和沸点高低均为C>D |
| B、A、B、C第一电离能的大小顺序为C>B>A |
| C、AD3和ED4两分子的中心原子均为sp3杂化 |
| D、ED4分子中各原子均达8电子结构 |
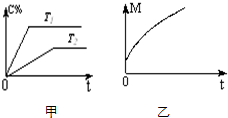 在密闭容器中投入一定量的A和B发生反应:m A(g)+n B(g)?p C(g)+q D(g).
在密闭容器中投入一定量的A和B发生反应:m A(g)+n B(g)?p C(g)+q D(g).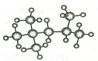 按系统命名法命名为:
按系统命名法命名为: