题目内容
5.当光束通过下列分散系时,能观察到丁达尔效应的是( )| A. | 泥水 | B. | 盐酸 | C. | Fe(OH)3胶体 | D. | NaCl溶液 |
分析 当一束光线透过胶体,从入射光的垂直方向可以观察到胶体里出现的一条光亮的“通路”,这种现象叫丁达尔现象,是胶体的特征性质用来区分溶液和胶体.
解答 解:A.泥水属于浊液,故A错误;
B.盐酸属于溶液,不会产生丁达尔效应,故B错误;
C.Fe(OH)3胶体属于胶体,能产生丁达尔效应,故C正确;
D.氯化钠溶液属于溶液,不会产生丁达尔效应,故D错误;
故选C.
点评 本题考查了胶体的性质,题目难度不大,丁达尔是胶体的特征性质,用于区别溶液和胶体.

练习册系列答案
相关题目
15.合成氨是基本无机化工,氨是化肥工业和有机化工的主要原料,也是一种常用的制冷剂.
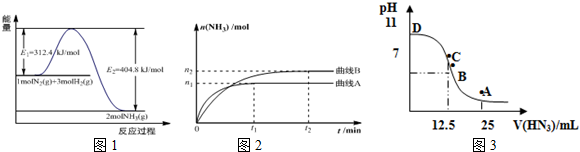
(1)图1是合成氨反应的能量与反应过程相关图(未使用催化剂);图2是合成氨反应在2L容器中、相同投料情况下、其它条件都不变时,某一反应条件的改变对反应的影响图.
①下列说法正确的是BDE.
A.使用催化剂会使E1的数值增大
B.△H=-92.4kJ•mol-1
C.为了提高转化率,工业生产中反应的温度越低越好
D.在曲线A条件下,反应从开始到平衡,消耗N2的平均速率为$\frac{{n}_{1}}{4{t}_{1}}$mol•L-1•min-1
E.该反应的平衡常数KA<KB
F.图2是不同压强下反应体系中氨的物质的量与反应时间关系图,且PA<PB
②下列能说明该反应达到平衡状态的是D
A.容器内N2、H2、NH3的浓度之比为1:3:2
B.v正(N2)=v逆(H2)
C.混合气体的密度保持不变
D.容器内压强保持不变
(2)合成氨技术的创立开辟了人工固氮的重要途径,合成氨反应的平衡常数K值和温度的关系如下:
400°C时,测得某时刻氨气、氮气、氢气的物质的量浓度分别为3mol•L-1、2mol•L-1、1mol•L-1时,此时刻该反应的v逆(N2)>v正(N2) (填“>”、“<”或“=”).
(3)常温下向25mL0.1mol/LNH3•H2O 溶液中,逐滴加入 0.2mol/L的HN3溶液,溶液的pH变化曲线如图3所示.
A、B、C、D 四个点中,水的电离程度最大的是C;A点时溶液中各离子浓度由小到大的顺序为c(OH-)<c(H+)<c(NH4+)<c(N3-).
(4)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制造新型燃料电池.试写出该电池的正极反应式N2+8H++6e-═2NH4+.

(1)图1是合成氨反应的能量与反应过程相关图(未使用催化剂);图2是合成氨反应在2L容器中、相同投料情况下、其它条件都不变时,某一反应条件的改变对反应的影响图.
①下列说法正确的是BDE.
A.使用催化剂会使E1的数值增大
B.△H=-92.4kJ•mol-1
C.为了提高转化率,工业生产中反应的温度越低越好
D.在曲线A条件下,反应从开始到平衡,消耗N2的平均速率为$\frac{{n}_{1}}{4{t}_{1}}$mol•L-1•min-1
E.该反应的平衡常数KA<KB
F.图2是不同压强下反应体系中氨的物质的量与反应时间关系图,且PA<PB
②下列能说明该反应达到平衡状态的是D
A.容器内N2、H2、NH3的浓度之比为1:3:2
B.v正(N2)=v逆(H2)
C.混合气体的密度保持不变
D.容器内压强保持不变
(2)合成氨技术的创立开辟了人工固氮的重要途径,合成氨反应的平衡常数K值和温度的关系如下:
| 温度/℃ | 200 | 300 | 400 |
| K | 1.0 | 0.86 | 0.5 |
(3)常温下向25mL0.1mol/LNH3•H2O 溶液中,逐滴加入 0.2mol/L的HN3溶液,溶液的pH变化曲线如图3所示.
A、B、C、D 四个点中,水的电离程度最大的是C;A点时溶液中各离子浓度由小到大的顺序为c(OH-)<c(H+)<c(NH4+)<c(N3-).
(4)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制造新型燃料电池.试写出该电池的正极反应式N2+8H++6e-═2NH4+.
16.某一海水资源利用的原理如图所示,下列有关说法正确的是( )
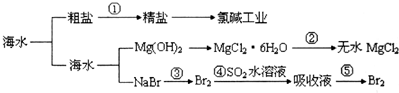

| A. | 第①步中除去粗盐中的SO42-、Ca2+、Mg2+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 | |
| B. | 工业上金属钠是通过氯碱工业制取的 | |
| C. | ④和⑤步的目的是为了浓缩 | |
| D. | 第③④⑤步中溴元素均被氧化 |
13.金属钛(Ti)性能优越,被称为继铁、铝后的“第三金属”.工业上以金红石为原料制取Ti的反应为:
aTiO2+bCl2+cC$\frac{\underline{\;1173K\;}}{\;}$aTiCl4+cCO …反应Ⅰ
TiCl4+2Mg$\frac{\underline{\;1220K~1420K\;}}{\;}$Ti+2MgCl2…反应Ⅱ
下列分析不正确的是( )
aTiO2+bCl2+cC$\frac{\underline{\;1173K\;}}{\;}$aTiCl4+cCO …反应Ⅰ
TiCl4+2Mg$\frac{\underline{\;1220K~1420K\;}}{\;}$Ti+2MgCl2…反应Ⅱ
下列分析不正确的是( )
| A. | TiCl4在反应I中是还原产物,在反应Ⅱ中是氧化剂 | |
| B. | C、Mg在反应中均为还原剂,被氧化 | |
| C. | 每生成19.2 g Ti,反应Ⅰ、Ⅱ中共转移1.6 mol e- | |
| D. | 反应I中b=c=2,反应II中Mg的还原性大于Ti |
20.食盐、食醋、纯碱等都是厨房常用的物质,其中属于盐的是( )
| A. | 食盐和食醋 | B. | 食盐和纯碱 | C. | 纯碱和食醋 | D. | 全部 |
10.在无色强酸性溶液中,下列各组离子能够大量共存的是( )
| A. | K+、Ba2+、Cl-、SO42- | B. | NH4+、HCO3-、Cl-、K+ | ||
| C. | Cl-、Na+、NO3-、Ca2+ | D. | Fe2+、NO3-、I-、Cl- |
14.在某无色碱性溶液中能大量共存的离子组是( )
| A. | Na+、K+、HCO3- | B. | NH4+、Al3+、SO42- | C. | Na+、AlO2-、NO3- | D. | Cu2+、SO42-、Cl- |
15.X、Y、Z、M、N代表五种金属.有以下化学反应:
①水溶液中:X+Y2+═X2++Y
②Z+2H2O(冷)═Z(OH)2+H2↑
③M、N为电极与N盐溶液组成原电池,发生的电极反应为:M-2e-═M2+
④Y可以溶于稀H2SO4中,M不被稀H2SO4氧化.
则这五种金属的活泼性由弱到强的顺序是( )
①水溶液中:X+Y2+═X2++Y
②Z+2H2O(冷)═Z(OH)2+H2↑
③M、N为电极与N盐溶液组成原电池,发生的电极反应为:M-2e-═M2+
④Y可以溶于稀H2SO4中,M不被稀H2SO4氧化.
则这五种金属的活泼性由弱到强的顺序是( )
| A. | M<N<Y<X<Z | B. | Y<X<N<M<Z | C. | N<M<Y<X<Z | D. | X<Z<N<M<Y |
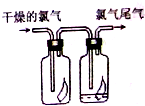 如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到右瓶的现象是:有色布条褪色,发生此现象的原因是Cl2+H2O?HCl+HClO.(用有关的方程式解释)
如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到右瓶的现象是:有色布条褪色,发生此现象的原因是Cl2+H2O?HCl+HClO.(用有关的方程式解释)