题目内容
19.将0.4gNaOH固体溶于水,得到1L溶液,c(0H-)=0.01mol/L,c(H+)=10-12mol/L,pH=12.分析 求出氢氧化钠的物质的量,然后根据物质的量浓度c=$\frac{n}{V}$来计算;由于氢氧化钠是一元强碱,故所得溶液中c(OH-)=c(NaOH),然后根据c(H+)=$\frac{Kw}{c(O{H}^{-})}$来计算,而溶液的pH=-lgc(H+)计算.
解答 解:0.4g氢氧化钠的物质的量n=$\frac{0.4g}{40g/mol}$=0.01mol,由于溶液体积为1L,故溶液的物质的量浓度c=$\frac{n}{V}$=$\frac{0.01mol}{1L}$=0.01mol/L;由于氢氧化钠是一元强碱,故所得溶液中c(OH-)=c(NaOH)=0.01mol/L,故c(H+)=$\frac{Kw}{c(O{H}^{-})}$=$\frac{1{0}^{-14}}{0.01}$=10-12mol/L,溶液的pH=-lgc(H+)=-lg10-12=12.故答案为:0.01mol/L;10-12mol/L;12.
点评 本题考查了所配置溶液的物质的量浓度和离子浓度以及溶液pH的有关计算,难度不大,注意掌握公式的运用.

练习册系列答案
相关题目
14.下列说法中,正确的是( )
| A. | 乙醇和乙醚互为同分异构体 | |
| B. | 乙醇和乙二醇互为同系物 | |
| C. | 含羟基的化合物一定属于醇类 | |
| D. | 等质量的乙醇、乙二醇与足量钠反应时,乙二醇产生的氢气的量较乙醇的多 |
4.2016年8月16日,长征二号丁运载火箭成功将“墨子号”量子科学实验卫星发射到预定轨道,火箭发射时燃料会发生反应:C2H5N2+2N2O4═2CO2↑+4H2O+3N2↑,下列关于该反应的说法错误的是( )
| A. | 该反应的△S<0 | B. | 该反应的△H<0 | ||
| C. | 该反应是不可逆反应 | D. | 该反应产物不会造成大气污染 |
11.某溶液中通人NO2仍能大量共存的离子是( )
| A. | Ag+、Na+、CO32- | B. | H+、Fe2+、Cl- | C. | Cu2+、H+、SO42- | D. | Ba2+、H+、SO42- |
8.将m g Al2O3、Fe2O3的混和物溶解在过量的100mL0.05mol/L的硫酸中,然后向其中加入NaOH溶液使Fe3+、Al3+刚好全部转化成沉淀,用去NaOH溶液100mL,则NaOH溶液的浓度为( )
| A. | 0.1mol/L | B. | 0.05mol/L | C. | 0.2mol/L | D. | 无法计算 |
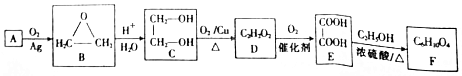
 .
.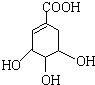 莽草酸是合成治疗禽流感的药物--达菲(Tamiflu)的原料之一.莽草酸是A的一种异构体.A的结构简式如下:
莽草酸是合成治疗禽流感的药物--达菲(Tamiflu)的原料之一.莽草酸是A的一种异构体.A的结构简式如下: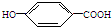 ),其反应类型是消去反应,化学方程式是
),其反应类型是消去反应,化学方程式是 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$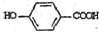 +2H2O.
+2H2O. .
.