题目内容
(1)6.02×1022个Mg2+约含 mol Mg2+,其质量为 g;
(2)3mol CO与2mol SO2的分子数比是 ,原子数比是 ;
(3)标准状况下,448ml某气体的质量为0.64g,这种气体的摩尔质量是 g/mol.
(2)3mol CO与2mol SO2的分子数比是
(3)标准状况下,448ml某气体的质量为0.64g,这种气体的摩尔质量是
考点:阿伏加德罗常数,摩尔质量
专题:阿伏加德罗常数和阿伏加德罗定律
分析:(1)根据n=
计算出镁离子的物质的量,再根据m=nM计算出镁离子的质量;
(2)根据n=
可知,物质的量与分子数成正比;根据二者分子组成计算出原子数之比;
(3)根据n=
计算出该气体的物质的量,再根据M=
计算出该气体的摩尔质量.
| N |
| NA |
(2)根据n=
| N |
| NA |
(3)根据n=
| V |
| 22.4L/mol |
| m |
| n |
解答:
(1)6.02×1022个Mg2+的物质的量为:
=0.1mol,镁离子的质量为:24g/mol×0.1mol=2.4g,
故答案为:0.1;2.4;
(2)3mol CO与2mol SO2的分子数比大于其物质的量之比,所以二者的分子数之比为:3mol:2mol=3:2;原子数之比为:3×2:2×3=1:1,
故答案为:3:2;1:1;
(3)标准状况下,448mL气体的物质的量为:
=0.02mol,该气体的摩尔质量为:
=32g/mol,
故答案为:32.
| 6.02×1022 |
| 6.02×1023/mol |
故答案为:0.1;2.4;
(2)3mol CO与2mol SO2的分子数比大于其物质的量之比,所以二者的分子数之比为:3mol:2mol=3:2;原子数之比为:3×2:2×3=1:1,
故答案为:3:2;1:1;
(3)标准状况下,448mL气体的物质的量为:
| 448×10-3L |
| 22.4L/mol |
| 0.64g |
| 0.02mol |
故答案为:32.
点评:本题考查了有关物质的量的简单计算,题目难度中等,注意掌握物质的量与阿伏伽德罗常数、摩尔质量等物理量之间的转化关系,试题培养了学生灵活应用所学知识的能力.

练习册系列答案
相关题目
1999年新发现的114号元素的一种同位素,其质量数为298,中子数为( )
| A、298 | B、184 |
| C、114 | D、70 |
 如图为短周期的一部分,推断关于Y、Z、M的说法正确的是( )
如图为短周期的一部分,推断关于Y、Z、M的说法正确的是( )| A、非金属性:Y>Z>M |
| B、阴离子还原性Z2->M- |
| C、原子半径:M>Z>Y |
| D、Y的最高价氧化物的水化物的化学式为HYO4 |
下列叙述正确的是( )
| A、氯气的水溶液能导电,所以氯气属于电解质 |
| B、稀H2SO4溶液能导电,稀H2SO4是电解质 |
| C、由于NH3?H2O溶于水,而Ca(OH)2微溶于水,所以NH3?H2O是强电解质,Ca(OH)2是弱电解质 |
| D、硫酸钡难溶于水,但硫酸钡属于强电解质 |
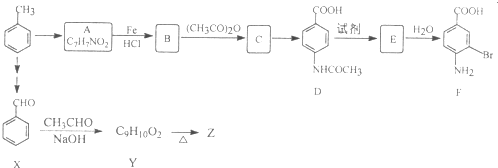
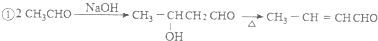
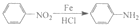 苯胺中氨基易被氧化.
苯胺中氨基易被氧化.