题目内容
 如图为短周期的一部分,推断关于Y、Z、M的说法正确的是( )
如图为短周期的一部分,推断关于Y、Z、M的说法正确的是( )| A、非金属性:Y>Z>M |
| B、阴离子还原性Z2->M- |
| C、原子半径:M>Z>Y |
| D、Y的最高价氧化物的水化物的化学式为HYO4 |
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:由元素在短周期中的位置可知,X为He、Y为F、M为Cl、Z为S,
A.同周期自左而右非金属性增强,同主族自上而下非金属性减弱;
B.电子层结构相同,核电荷数越大离子半径越小;
C.同周期自左而右原子半径减小,同主族自上而下原子半径增大;
D.F元素没有最高价含氧酸.
A.同周期自左而右非金属性增强,同主族自上而下非金属性减弱;
B.电子层结构相同,核电荷数越大离子半径越小;
C.同周期自左而右原子半径减小,同主族自上而下原子半径增大;
D.F元素没有最高价含氧酸.
解答:
解:由元素在短周期中的位置可知,X为He、Y为F、M为Cl、Z为S,
A.同周期自左而右非金属性增强,同主族自上而下非金属性减弱,故非金属性Y>M>Z,故A错误;
B.电子层结构相同,核电荷数越大离子半径越小,故离子半径S2->Cl-,故B正确;
C.同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径Z>M>Y,故C错误;
D.Y为F元素,没有最高价含氧酸,故D错误,
故选B.
A.同周期自左而右非金属性增强,同主族自上而下非金属性减弱,故非金属性Y>M>Z,故A错误;
B.电子层结构相同,核电荷数越大离子半径越小,故离子半径S2->Cl-,故B正确;
C.同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径Z>M>Y,故C错误;
D.Y为F元素,没有最高价含氧酸,故D错误,
故选B.
点评:本题考查元素周期表与元素周期律的应用,比较基础,D选项为易错点,学生容易忽略氟元素没有最高正化合价.

练习册系列答案
相关题目
下列各有机物的命名正确的是( )
| A、CH2=CHCH=CH2 1,3-二丁烯 |
B、甲基苯酚 |
| C、CH2=C(CH2CH3)2 2-乙基-1-丁烯 |
| D、CH3OCH3 乙醚 |
在通常条件下,下列各组物质的性质排列正确的是( )
| A、熔点:CO2>KCl>SiO2 |
| B、热稳定性:HF>H2O>NH3 |
| C、沸点:乙烷>戊烷>丁烷 |
| D、水溶性:HCl>H2S>SO2 |
下列与化学反应过程中的能量变化相关的叙述中,不正确的是( )
| A、化学反应热效应数值与参加反应的物质多少有关 |
| B、放热反应的反应速率总是大于吸热反应的反应速率 |
| C、应用盖斯定律,可计算某些难以直接测量的反应焓变 |
| D、化学反应过程中的能量变化除了热能外,也可以是光能、电能等 |
10ml浓度为0.1mol/LNaCL溶液和10ml浓度为0.1mol/L NaF溶液相比较阴离子数目( )
| A、相等 | B、前者大 |
| C、后者大 | D、无法确定 |
用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A、25℃时,1L pH=13的Ba(OH)2溶液中含有的OH-数目为0.2NA |
| B、标准状况下,1molCF4中含有的电子对数目为4.0NA |
| C、1L 0.5mol?L-1 的H2SO3溶液中含有的H+数目为NA |
| D、1molN2与3molH2混合充分反应后生成NH3分子数小于2.0NA |
在稀盐酸中能大量共存的离子组是( )
| A、Ag+、Ba2+、C1一 |
| B、Na+、SO32一、S2一 |
| C、NH4+、Mg2+、SO42- |
| D、K+、Fe2+、OH- |
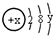 ,试回答:
,试回答: