题目内容
16.下列叙述中正确的是( )| A. | 常温下,2NO(g)+O2(g)═2NO2(g)能够自发进行,则该反应的△H<0 | |
| B. | 反应N2(g)+3H2(g)?2NH3(g),其他条件不变时充入N2,正反应速率增大,逆反应速率减小 | |
| C. | 同温、同浓度的硫酸和氢氧化钠稀溶液中,水的电离程度相同 | |
| D. | 硫酸工业中二氧化硫的催化氧化,不采用高压是因为压强对SO2转化率无影响 |
分析 A、根据△H-T△S<0反应自发进行判断;
B、反应N2(g)+3H2(g)?2NH3(g),其他条件不变时充入N2,正逆反应都加快;
C、同温、同浓度的硫酸和氢氧化钠稀溶液中,硫酸是二元酸,同浓度硫酸和氢氧化钠溶液中氢离子的浓度大于氢氧根离子的浓度,所以氢氧化钠溶液中水的电离程度大;
D、压强对化学反应前后气体体积变化的反应的平衡移动有影响.
解答 解:A、常温下,2NO(g)+O2(g)=2NO2(g)能够自发进行,说明△H-T△S<0,已知该反应△S<0,所以该反应的△H<0,故A正确;
B、反应N2(g)+3H2(g)?2NH3(g),其他条件不变时充入N2,正逆反应都加快,故B错误;
C、同温、同浓度的硫酸和氢氧化钠稀溶液中,硫酸是二元酸,同浓度硫酸和氢氧化钠溶液中氢离子的浓度大于氢氧根离子的浓度,所以氢氧化钠溶液中水的电离程度大,两者水的电离程度不同,故C错误;
D、二氧化硫的催化氧化不采用高压是考虑设备的耐压程度,压强对化学平衡会产生影响,增大压强,有利于二氧化硫的转化,故D错误;
故选A.
点评 本题目综合考查学生反应的自发性、外界条件对化学反应速率的影响及化学平衡的影响因素等知识,属于综合知识的考查,难度不大.

练习册系列答案
相关题目
7.甲乙两份铝屑,分别与同浓度的盐酸和NaOH溶液反应,产生的氢气的体积比为1:2(相同状况下),则甲乙反应中消耗酸、碱的物质的量之比为 ( )
| A. | 1:l | B. | 1:2 | C. | 3:2 | D. | 2:3 |
4.“保护环境,就是保护人类自己”.下列环境问题与产生的主要原因不相符的是( )
①“臭氧空洞”主要是大量使用氟氯代烃等引起的
②“光化学烟雾”主要是由NO2等引起的
③“酸雨”主要是由空气中CO2浓度增大引起的
④“白色污染”主要是由聚乙烯塑料等引起的.
①“臭氧空洞”主要是大量使用氟氯代烃等引起的
②“光化学烟雾”主要是由NO2等引起的
③“酸雨”主要是由空气中CO2浓度增大引起的
④“白色污染”主要是由聚乙烯塑料等引起的.
| A. | 只有①② | B. | 只有②③ | C. | 全部 | D. | 只有③ |
11.下列对有机物或有机物的官能团的认识正确的是( )
| A. | .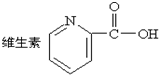 中的含氧官能团的名称是:羧基 中的含氧官能团的名称是:羧基 | |
| B. | 分子式为C4H8的烃中一定含有官能团碳碳双键 | |
| C. | 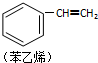 1 mol苯乙烯(如图)中含有的C═C键数为4NA(NA为阿伏加德罗常数) 1 mol苯乙烯(如图)中含有的C═C键数为4NA(NA为阿伏加德罗常数) | |
| D. | 丙烯的结构简式可以表示为:CH3CHCH2 |
1.下列说法不正确的是( )
| A. | 在船舶的外壳装上镁合金或锌块保护钢铁设备被称为牺牲阳极的阴极保护法 | |
| B. | 赤潮、白色污染、绿色食品中的“赤”“白”“绿”均指相关物质的颜色 | |
| C. | 海水淡化的方法主要有:蒸馏法、电渗析法、离子交换法等 | |
| D. | 乙烯的产量可以用来衡量一个国家的石油化工发展水平 |
8.向下列溶液中逐渐通入SO2,一直不产生沉淀的是( )
| A. | Ca(OH)2溶液 | B. | 浓的CaCl2溶液 | C. | Ba(NO3)2溶液 | D. | H2S的水溶液 |
6.短周期元素 A、B、C、D、E 的原子序数依次增大;A 的最高价氧化物与 B 的氢化物在水中反应得到的生成物既可与酸反应又可与碱反应;C、D 为金属元素,且 D 原子最外层电子数等于其 K 层电子数,而 C 的阳离子半径大于 D 的阳离子;若往 E 单质的水溶液中滴加少量紫色石蕊试液,能观察到先变红后褪色.下列说法中正确的是( )
| A. | B的氢化物和E的氢化物能相互反应,且得到的产物只含有共价键 | |
| B. | C在元素周期表中的位置是第三周期第ⅠA族 | |
| C. | 金属D能在A的最高价氧化物中燃烧,生成A的化合物 | |
| D. | E单质的水溶液使紫色石蕊试液先变红后褪色,说明E单质具有漂白性 |
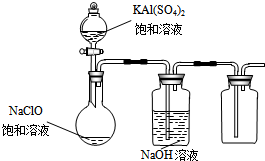 NaClO和KAl(SO4)2都是重要的化工产品,均可应用于造纸业.
NaClO和KAl(SO4)2都是重要的化工产品,均可应用于造纸业.