题目内容
4.FeCl3、CuCl2的混合溶液中加入铁粉,充分反应后仍有固体存在,则下列判断正确的是( )| A. | 加入KSCN溶液不一定变红色 | B. | 溶液中一定含Fe2+ | ||
| C. | 溶液中一定含Cu2+ | D. | 剩余固体中一定含Cu和Fe |
分析 Fe3+、Cu2+的氧化性强弱为:Fe3+>Cu2+,Fe3+优先反应,固体有剩余,则反应后的溶液中一定不存在Fe3+;若剩余固体只有Cu,则反应后的溶液中一定Fe3+存在,一定存在Fe2+,可能含有Cu2+;若有Fe剩余,一定有铜生成,Fe3+和Cu2+无剩余,据此进行判断.
解答 解:①当固体为铁、铜时,溶液中的Fe3+、Cu2+全部参加反应生成Fe2+和Cu,反应的方程式为:2FeCl3+Fe=3FeCl2、CuCl2+Fe=Cu+FeCl2,所以溶液中一定没有Fe3+、Cu2+,一定含有Fe2+;
②当固体为铜时,溶液中一定没有Fe3+,Cu2+恰好全部参加反应或部分反应生成Fe2+和Cu,所以溶液中一定没有Fe3+,可能含有Cu2+,一定含有Fe2+;
A.由于金属有剩余,溶液中一定不存在Fe3+,所以加入KSCN溶液一定不变红色,故A错误;
B.固体有剩余,Fe3+、Cu2+的氧化性强弱为:Fe3+>Cu2+,Fe3+优先反应,溶液中一定存在Fe2+,故B正确;
C.若有Fe剩余,一定有铜生成,Fe3+和Cu2+无剩余,故C错误;
D.若铁过量,剩余的固体为铜和铁的混合物,故D错误;
故选B.
点评 本题考查了Fe3+、Cu2+的氧化能力大小的比较,题目难度中等,正确判断Fe3+、Cu2+的氧化性强弱及固体的成分是解本题的关键,注意掌握铁离子与金属铜、铁反应的化学方程式.

练习册系列答案
 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案
相关题目
14.下列物质在水溶液中的电离方程式书写正确的是 ( )
| A. | NaHCO3═Na++H++CO32- | B. | NaHSO4═Na++HSO4- | ||
| C. | Al2 (SO4)3═Al 3++SO42- | D. | Na2SO4═2Na++SO42 |
15.据报道,继通过食盐补碘在全国范围内基本实现消除碘缺乏病目标之后,我国又将启动一项涉及千家万户营MgSO4养健康问题的“补铁工程”.卫生部已批准以酱油为食物载体,逐步开展补铁工程.这里的碘、铁指的是( )
| A. | 元素 | B. | 原子 | C. | 分子 | D. | 单质 |
12.能表示阿伏加德罗常数数值的是( )
| A. | 1 mol金属钠含有的电子数 | |
| B. | 0.012 kg 12C中含有的碳原子数 | |
| C. | 1 mol H2SO4完全溶于水后电离出的H+的个数 | |
| D. | 27 g Al与足量稀硫酸反应后生成H2的分子数 |
9.NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 2.0gH2O与D2O的混合物中所含中子数为NA | |
| B. | 标准状况下1.4 g乙烯所含共用电子对数为0.25NA | |
| C. | 3 mol单质Fe完全转变为Fe3O4,失去8 NA个电子 | |
| D. | 50ml 12 mol•L-1盐酸与足量MnO2共热,转移的电子数为0.3NA |
16.已知(CH3)2C=CH2,可表示为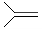 ,脱落酸(如图)可用作植物生长抑制剂,下
,脱落酸(如图)可用作植物生长抑制剂,下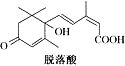 列对该物质的叙述正确的是( )
列对该物质的叙述正确的是( )
 ,脱落酸(如图)可用作植物生长抑制剂,下
,脱落酸(如图)可用作植物生长抑制剂,下 列对该物质的叙述正确的是( )
列对该物质的叙述正确的是( )| A. | 其分子式为C15H22O4 | |
| B. | 其属于芳香族化合物 | |
| C. | 能与氢氧化钠溶液反应,但不能与碳酸氢钠溶液反应 | |
| D. | 该物质在一定条件下可发生自身取代反应生成含七元环的物质. |
3.苯甲醇又称为苄醇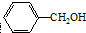 ,可用于制作香料和调味剂,还可以用作明胶、虫胶、酪蛋白及醋酸纤维等的溶剂,则苯甲醇的含苯环同分异构体有( )
,可用于制作香料和调味剂,还可以用作明胶、虫胶、酪蛋白及醋酸纤维等的溶剂,则苯甲醇的含苯环同分异构体有( )
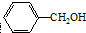 ,可用于制作香料和调味剂,还可以用作明胶、虫胶、酪蛋白及醋酸纤维等的溶剂,则苯甲醇的含苯环同分异构体有( )
,可用于制作香料和调味剂,还可以用作明胶、虫胶、酪蛋白及醋酸纤维等的溶剂,则苯甲醇的含苯环同分异构体有( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |