题目内容
16.已知(CH3)2C=CH2,可表示为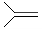 ,脱落酸(如图)可用作植物生长抑制剂,下
,脱落酸(如图)可用作植物生长抑制剂,下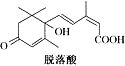 列对该物质的叙述正确的是( )
列对该物质的叙述正确的是( )| A. | 其分子式为C15H22O4 | |
| B. | 其属于芳香族化合物 | |
| C. | 能与氢氧化钠溶液反应,但不能与碳酸氢钠溶液反应 | |
| D. | 该物质在一定条件下可发生自身取代反应生成含七元环的物质. |
分析 A.根据结构简式确定分子式;
B.含有苯环的有机物为芳香族化合物;
C.酚羟基、羧基、酯基能和NaOH溶液反应,只有羧基能和碳酸氢钠反应;
D.该物质中羧基和醇羟基能发生分子内酯化反应.
解答 解:A.根据结构简式确定分子式为C15H20O4,故A错误;
B.含有苯环的有机物为芳香族化合物,该物质中不含苯环,所以不能芳香族化合物,故B错误;
C.该物质中含有羧基,所以能与NaOH和碳酸氢钠反应,故C错误;
D.分子中含有羟基、羧基,可发生酯化反应,由羟基和羧基的相对位置可知在一定条件下发生反应生成含七元环的物质,故D正确.
故选D.
点评 本题考查有机物的结构和性质,为高考常见题型,侧重于学生的分析能力的考查,注意把握有机物的官能团的性质和有机物的结构特点,易错选项是D,题目难度不大.

练习册系列答案
相关题目
6.关于原子序数为53的元素,以下说法正确的是( )
| A. | 位于第六周期 | B. | 是金属元素 | ||
| C. | 最外电子层含有6个电子 | D. | 属于卤族元素 |
7.使用石油热裂解的副产物CH4来制取CO和H2,其生产流程如图:
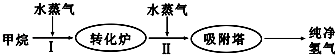
(1)工业上常利用反应Ⅰ产生的CO和H2合成可再生能源甲醇.
①已知CO(g)、CH3OH(l)的燃烧热分别为283.0kJ•mol-1和726.5kJ•mol-1,则CH3OH(l)不完全燃烧生成CO(g)和H2O(l)的热化学方程式为CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-443.5kJ•mol-1.
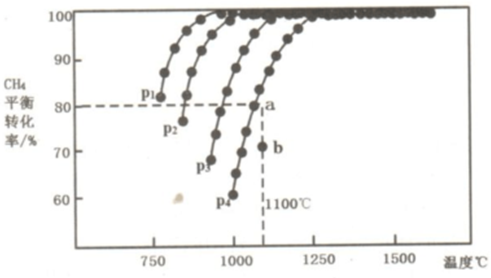
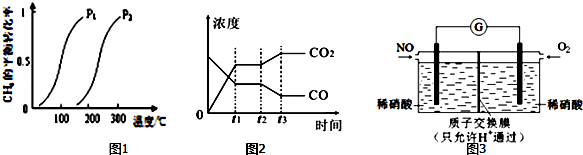
此流程的第Ⅰ步反应为:CH4(g)+H2O(g)?CO(g)+3H2(g),一定条件下CH4的平衡转化率与温度、压强的关系如图1.则P1<P2.(填“<”、“>”或“=”)100℃时,将1mol CH4和2mol H2O通入容积为10L的恒容密闭容器中,达到平衡时CH4的转化率为0.5.此时该反应的平衡常数K=2.25×10-2.
(3)此流程的第Ⅱ步反应CO(g)+H2O(g)?CO2(g)+H2(g),的平衡常数随温度的变化如表:
从上表可以推断:该反应是放热反应(填“吸热”或“放热”),若在500℃时进行,设起始时CO和H2O的起始浓度均为0.020mol/L,在该条件下,反应达到平衡时,CO的转化率为75%.图2表示该反应在t1时刻达到平衡、在t2时刻因改变某个条件引起浓度变化的情况:图2中t2时刻发生改变的条件是降低温度.增加水蒸汽的量或减少氢气的量(写出一种).
(4)某化学兴趣小组构想将NO转化为HNO3(NO3-),装置如图3,电极为多孔惰性材料.则负极的电极反应式是2H2O+NO-3e-=NO3-+4H+.

(1)工业上常利用反应Ⅰ产生的CO和H2合成可再生能源甲醇.
①已知CO(g)、CH3OH(l)的燃烧热分别为283.0kJ•mol-1和726.5kJ•mol-1,则CH3OH(l)不完全燃烧生成CO(g)和H2O(l)的热化学方程式为CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-443.5kJ•mol-1.
此流程的第Ⅰ步反应为:CH4(g)+H2O(g)?CO(g)+3H2(g),一定条件下CH4的平衡转化率与温度、压强的关系如图1.则P1<P2.(填“<”、“>”或“=”)100℃时,将1mol CH4和2mol H2O通入容积为10L的恒容密闭容器中,达到平衡时CH4的转化率为0.5.此时该反应的平衡常数K=2.25×10-2.
(3)此流程的第Ⅱ步反应CO(g)+H2O(g)?CO2(g)+H2(g),的平衡常数随温度的变化如表:
| 温度/℃ | 400 | 500 | 830 |
| 平衡常数K | 10 | 9 | 1 |
(4)某化学兴趣小组构想将NO转化为HNO3(NO3-),装置如图3,电极为多孔惰性材料.则负极的电极反应式是2H2O+NO-3e-=NO3-+4H+.

4.FeCl3、CuCl2的混合溶液中加入铁粉,充分反应后仍有固体存在,则下列判断正确的是( )
| A. | 加入KSCN溶液不一定变红色 | B. | 溶液中一定含Fe2+ | ||
| C. | 溶液中一定含Cu2+ | D. | 剩余固体中一定含Cu和Fe |
1.反应2SO2+O2?2SO3(△H<0)达到平衡时,要想使平衡向右移动,应采取的措施是( )
| A. | 减小压强 | B. | 升高温度 | C. | 增加SO2浓度 | D. | 加入催化剂 |
8.某气体由烯烃和炔烃混合而成,经测定其密度为同条件下H2的13.5倍,则下列说法中正确的是( )
| A. | 混合气体中一定没有乙炔 | B. | 混合气体中一定有乙稀 | ||
| C. | 混合气体可能由乙炔和丙烯组成 | D. | 混合气体一定由乙烯和乙炔组成 |
16.下列与化学反应能量变化相关的叙述正确的是( )
| A. | 石油、沼气、天然气、植物油都属于可再生能源 | |
| B. | 应用盖斯定律,可计算某些难以直接测量的反应焓变 | |
| C. | 水蒸气变为液态水时放出的能量就是该变化的反应热 | |
| D. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H不同 |