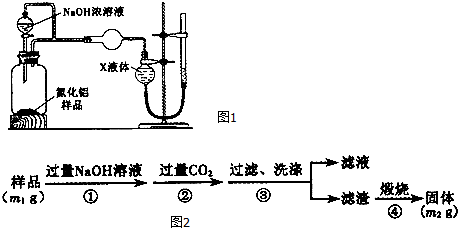
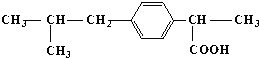
题目内容
1.下列说法正确的是( )| A. | FeCl3和NaHCO3的固体混合物,加热时有气体产生,加水溶解时有沉淀生成. | |
| B. | 25℃与60℃时,水的pH相等 | |
| C. | 中和等体积、等物质的量的浓度的盐酸和醋酸所消耗的n(NaOH)不相等 | |
| D. | 2SO2(g)+O2(g)═2SO3(g)和 4SO2(g)+2O2(g)=4SO3(g)的△H相等 |
分析 A.加热时碳酸氢钠分解生成二氧化碳气体,加水时而在发生双水解反应生成氢氧化铁沉淀;
B.升高温度,水的电离程度增大,溶液中氢离子浓度增大,溶液的pH减小;
C.等体积、等物质的量的浓度的盐酸和醋酸溶液中含有等物质的量的HCl和醋酸,则消耗的氢氧化钠的物质的量相等;
D.焓变数值与反应物的化学计量数成正比.
解答 解:A.FeCl3和NaHCO3的固体混合物,加热时碳酸氢钠分解会生成二氧化碳气体,加水溶解时铁离子与碳酸氢根离子发生双水解反应生成氢氧化铁沉淀和二氧化碳气体,故A正确;
B.温度影响水的电离,25℃与60℃时水的电离程度不同,则水在氢离子浓度不相等,所以两种温度下水的pH不相等,故B错误;
C.等体积、等物质的量的浓度的盐酸和醋酸,根据n=cV可知两溶液中含有的HCl和醋酸的物质的量相等,二者都是一元酸,则中和两溶液时所消耗的n(NaOH)相等,故C错误;
D.2SO2(g)+O2(g)═2SO3(g)和 4SO2(g)+2O2(g)=4SO3(g)中,由于化学计量数不相等,则两个反应的△H不相等,故D错误;
故选A.
点评 本题考查了弱电解质的电离、反应热比较、酸碱混合的定性判断等知识,题目难度中等,注意掌握弱电解质的电离平衡及其影响,明确酸碱混合的定性判断方法及热化学方程式中焓变与化学计量数的关系,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
11.下列有关金属的说法正确的是( )
①铁钉在潮湿的空气容易生锈 ②钠着火用水扑灭 ③铝在空气中耐腐蚀,所以铝是不活泼金属 ④用酒精灯加热铝箔至熔化,铝并不滴落,说明氧化铝的熔点比铝高⑤青铜、不锈钢都是合金 ⑥KSCN溶液可以检验Fe3+.
①铁钉在潮湿的空气容易生锈 ②钠着火用水扑灭 ③铝在空气中耐腐蚀,所以铝是不活泼金属 ④用酒精灯加热铝箔至熔化,铝并不滴落,说明氧化铝的熔点比铝高⑤青铜、不锈钢都是合金 ⑥KSCN溶液可以检验Fe3+.
| A. | ①④⑤⑥ | B. | ②③④⑤ | C. | ①③④⑤ | D. | ①②⑤⑥ |
9.下列物质中,能够导电的电解质是( )
| A. | Cu丝 | B. | NaCl溶液 | C. | 熔融的NaOH | D. | 蔗糖 |
6.化学与科学、技术、社会、环境密切相关.下列有关说法中正确的是( )
| A. | 高纯度的硅广泛用于制作光导纤维,光导纤维遇强碱会“断路” | |
| B. | 煤经过气化和液化两个物理变化,可变为清洁能源 | |
| C. | 如将材料均匀分散到某液体分散剂中,该分散系可发生丁达尔现象,由此可推测该材料的直径为1~100pm之间 | |
| D. | 屠呦呦女士利用乙醚萃取青蒿素获得了2015年度诺贝尔生理学或医学奖,为人类防治疟疾作出了重大贡献 |
13.关于图中各装置的叙述不正确的是( )
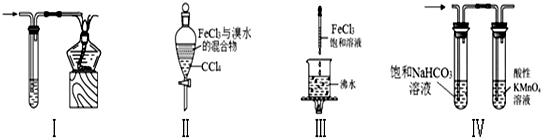

| A. | 装置Ⅰ:可用于处理CO尾气 | |
| B. | 装置Ⅱ:充分振荡后静置,下层溶液为红棕色,上层无色 | |
| C. | 装置Ⅲ:当液体呈红褐色,停止加热,让光束通过体系可产生丁达尔效应 | |
| D. | 装置Ⅳ:可用于除去CO2气体中的HCl和SO2气体 |
11.常温下,下列各组离子在指定的条件下一定能大量共存的是( )
| A. | c(Fe3+)=0.1mol•L-1的溶液中:K+、ClO-、SO42-、SCN- | |
| B. | 在pH=2的溶液中:NH4+、K+、ClO-、Cl- | |
| C. | 在c(H+)/c(OH-)=10-12的溶液中:K+、Na+、C1O-、NO3- | |
| D. | 水电离c(H+)=10-12的溶液中:Mg2+、Cu2+、SO42+、K+ |