题目内容
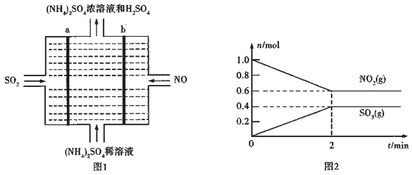
1.X、Y、Z、R、W是原子序数递增的五种短周期主族元素,周期数之和为11,其中Y元素最高化合价与最低化合价代数和为2,Z和R可形成R2Z和R2Z2型化合物,R是五种元素中原子半径最大的,Z和W是同族元素,下列说法错误的是( )| A. | 简单离子半径大小顺序为:W>Z>R | |
| B. | X2Z2的电子式为: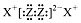 | |
| C. | X2Z的沸点比X2W的沸点高 | |
| D. | Y元素最高价氧化物的水化物浓溶液可以用铝制容器盛装 |
分析 X、Y、Z、R、W是原子序数递增的五种短周期主族元素,Z和R可形成R2Z和R2Z2型化合物,R是五种元素中原子半径最大的,可知R为Na,Z为O,Z和W是同族元素,W为S,周期数之和为11,X、R的周期数之和为11-3-3-2=3,则X为H,Y为第二周期元素,其中Y元素最高化合价与最低化合价代数和为2,Y为N元素,以此来解答.
解答 解:由上述分析可知,X为H,Y为N,Z为O,R为Na,W为S,
A.电子层越多,原子半径越大,具有相同电子排布的离子中原子序数大的离子半径小,则简单离子半径大小顺序为:W>Z>R,故A正确;
B.H2O2的电子式为 ,故B错误;
,故B错误;
C.水分子间含氢键,则X2Z的沸点比X2W的沸点高,故C正确;
D.常温下浓硫酸遇Al发生钝化,则元素最高价氧化物的水化物浓溶液可以用铝制容器盛装,故D正确;
故选B.
点评 本题考查原子结构与元素周期律,为高频考点,把握元素化合物性质、元素的性质来推断元素为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
19.Na、Al、Fe都是重要的金属元素.下列说法正确的是( )
| A. | 氧化物都是碱性氧化物 | B. | 氢氧化物都是白色固体 | ||
| C. | 单质都可以与水反应 | D. | 单质在空气中都形成致密氧化膜 |
9.下列说法正确的是( )
| A. | ${\;}_{6}^{12}$C、${\;}_{6}^{13}$C、${\;}_{6}^{14}$C三种核素互为同素异形体 | |
| B. | 苯甲醇和邻甲基苯酚的分子式相同,化学性质也相同 | |
| C. | 等质量的甲烷按a、b两种途径完全转化,途径a比途径b消耗更多的O2 途径a:CH4$→_{催化重整}^{H_{2}O}$CO+H2$→_{燃烧}^{O_{2}}$CO2+H2O;途径b:CH4$→_{燃烧}^{O_{2}}$CO2+H2O | |
| D. | 铁表面镀铜时,铜与电源的正极相连,铁与电源的负极相连 |
16.短周期元素X、Y、Z、W的原子序数依次增大;X与Y、W可分别形成10e-、18e-的化合物甲和化合物乙,甲为非电解质,乙为强电解质,甲与乙常温下可化合得到离子化合物丙.X、Y、Z的最外层电子数之和等于W的最外层电子数.则下列说法正确的是( )
| A. | 化合物甲比乙的沸点低 | |
| B. | X、Y、Z、W的简单离子半径大小为:W>Y>Z>X | |
| C. | 丙属于正盐,其水溶液呈中性 | |
| D. | X和Z形成的二元化合物与乙的化学键类型相同 |
6. 黄曲霉毒素B1 (AFBI)是已知化学物质中致癌性最强的一种,其结构简式如图所示.下列说法正确的是( )
黄曲霉毒素B1 (AFBI)是已知化学物质中致癌性最强的一种,其结构简式如图所示.下列说法正确的是( )
 黄曲霉毒素B1 (AFBI)是已知化学物质中致癌性最强的一种,其结构简式如图所示.下列说法正确的是( )
黄曲霉毒素B1 (AFBI)是已知化学物质中致癌性最强的一种,其结构简式如图所示.下列说法正确的是( )| A. | AFBI分子中有2个手性碳原子 | B. | AFBI分子中所有原子处于同一平面 | ||
| C. | 1moIAFBI最多可与2moINaOH反应 | D. | 1molAFBI最多可与5molH2发生加成 |
13.如图是元素周期表的一部分
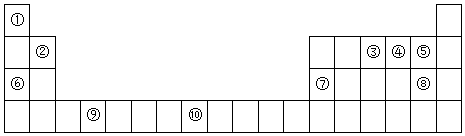
(1)元素⑩原子结构示意图为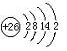 .
.
(2)元素 ③④⑤的电负性由大到小的顺序为F>O>N(填化学用语,下同),其简单离子半径由大到小的顺序为N3->O2->F-.⑤与⑧气态氢化物中稳定性较强的是HF.
(3)某些不同族元素的性质也有一定的相似性,如上表中元素⑦与元素②的单质及其化合物有相似的性质.写出元素②的最高价氧化物与NaOH溶液反应的离子方程式2OH-+BeO=BeO22-+H2O
(4)根据下列五种元素的第一至第四电离能数据(单位:KJ•mol-1),回答下面各题:
①在周期表中,最可能处于同一主族的是R和U.(填元素代号)
②T元素最可能是p(填“s”、“p”、“d”、“ds”等)区元素;若T为第二周期元素,Z是第三周期元素中原子半径最小的主族元素,则T、Z形成的化合物分子键角为120°.
(5)金刚砂(SiC)的结构与金刚石相似,硬度与金刚石相当,则金刚砂的晶胞中含有4个硅原子,4个碳原子,其中硅原子的杂化方式为sp3.

(1)元素⑩原子结构示意图为
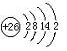 .
.(2)元素 ③④⑤的电负性由大到小的顺序为F>O>N(填化学用语,下同),其简单离子半径由大到小的顺序为N3->O2->F-.⑤与⑧气态氢化物中稳定性较强的是HF.
(3)某些不同族元素的性质也有一定的相似性,如上表中元素⑦与元素②的单质及其化合物有相似的性质.写出元素②的最高价氧化物与NaOH溶液反应的离子方程式2OH-+BeO=BeO22-+H2O
(4)根据下列五种元素的第一至第四电离能数据(单位:KJ•mol-1),回答下面各题:
| 元素代号 | I1 | I2 | I3 | I4 |
| Q | 2080 | 4000 | 6100 | 9400 |
| R | 500 | 4600 | 6900 | 9500 |
| S | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| U | 420 | 3100 | 4400 | 5900 |
②T元素最可能是p(填“s”、“p”、“d”、“ds”等)区元素;若T为第二周期元素,Z是第三周期元素中原子半径最小的主族元素,则T、Z形成的化合物分子键角为120°.
(5)金刚砂(SiC)的结构与金刚石相似,硬度与金刚石相当,则金刚砂的晶胞中含有4个硅原子,4个碳原子,其中硅原子的杂化方式为sp3.
10.某有机物的结构简式如图所示,下列有关该有机物的说法正确的是( )
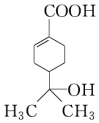

| A. | 分子中含有两种官能团 | |
| B. | 可使溴水和酸性高锰酸钾溶液褪色,且原理相同 | |
| C. | 该有机物的分子式为C10H16O3 | |
| D. | 与钠和氢氧化钠溶液都能发生反应,且得到的产物相同 |
11.下列化学用语正确的是( )
| A. | NaCl的电子式: | B. | 硫离子的结构示意图: | ||
| C. | 氮气的结构式::N≡N: | D. | 次氯酸的电子式:H:Cl:O: |