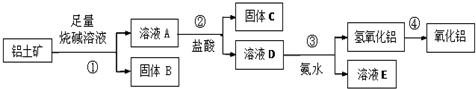
题目内容
10.随原子序数的递增,八种短周期元素(用字母表示)原子半径的相对大小、最高正价或最低负价的变化如图所示.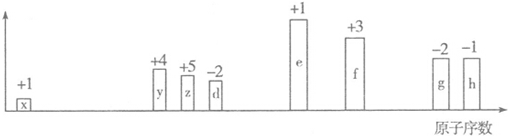
根据判断出的元素回答问题:
(1)y在元素周期表中的位置是第二周期IVA族.z、d、e、f四种元素的简单离子中,半径最大的是N3-(填离子符号)
(2)e的氢氧化物是一种重要的基本化工原料,写出工业上制备该氢氧化物的离子方程 式2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+Cl2↑+H2↑.
(3)z的氢化物和h的氢化物反应形成化合物A,A中含有的化学键类型为离子键、共价键;
(4)含f的某化合物可用作净水剂的原理是Al3++3H2O=Al(OH)3(胶体)+3H+(用离子方程式表示)
(5)25℃,f的最高价氧化物的水化物的Ksp=1.0×10-34,使含0.1mol•L-1 f离子的溶液开始产生沉淀的pH为3.
(6)元素e和g组成的化合物B的水溶液中离子浓度由大到小的顺序为c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+).
分析 从图中的化合价、原子半径的大小及原子序数,可知x是H元素,y是C元素,z是N元素,d是O元素,e是Na元素,f是Al元素,g是S元素,h是Cl元素.
(1)主族元素周期数=电子层数、主族族序数=最外层电子数;
电子层结构相同的离子,核电荷数越大离子半径越小,电子层越多离子半径越大;
(2)工业上电解饱和氯化钠溶液生成氢氧化钠;
(3)z的氢化物和h的氢化物反应形成化合物A为NH4Cl;
(4)铝盐溶液中铝离子水解为氢氧化铝胶体,可以用于净水;
(5)根据溶度积计算溶液中氢氧根离子浓度,进而计算氢离子浓度,再根据pH=-lgc(H+)计算;
(6)元素e和g组成的化合物B为Na2S,溶液中硫离子水解,溶液呈碱性,溶液中氢氧根离子源于硫离子水解、硫氢根水解、水的电离.
解答 解:从图中的化合价、原子半径的大小及原子序数,可知x是H元素,y是C元素,z是N元素,d是O元素,e是Na元素,f是Al元素,g是S元素,h是Cl元素.
(1)y为碳元素,处于周期表中第二周期IVA族,电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径:r(N3-)>r(O2-)>r(Na+)>r(Al3+);
故答案为:第二周期IVA族;N3-;
(2)工业上电解饱和氯化钠溶液生成氢氧化钠,离子方程式为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+Cl2↑+H2↑,
故答案为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+Cl2↑+H2↑;
(3)z的氢化物和h的氢化物反应形成化合物A为NH4Cl,含有离子键、共价键,
故答案为:离子键、共价键;
(4)铝盐溶液中铝离子水解:Al3++3H2O=Al(OH)3(胶体)+3H+,生成氢氧化铝胶体,可以用于净水,
故答案为:Al3++3H2O=Al(OH)3(胶体)+3H+;
(5)Al3+沉淀时c(OH-)=$\root{3}{\frac{1.0×1{0}^{34}}{0.1}}$mol/L=10-11mol/L,则c(H+)=$\frac{1{0}^{-14}}{1{0}^{-11}}$mol/L=10-3mol/L,此时溶液pH=-lgc(H+)=3,
故答案为:3;
(6)元素e和g组成的化合物B为Na2S,溶液中硫离子水解,溶液呈碱性,溶液中氢氧根离子源于硫离子水解、硫氢根水解、水的电离,溶液中离子浓度大小为:c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+),
故答案为:c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+).
点评 本题考查结构性质位置关系应用,根据化合价与原子半径推断元素是解题关键,注意对元素周期律的理解掌握.

①NaOH溶液 ②NaCl溶液 ③氨水溶液 ④新制氯水 ⑤H2S⑥CO2.
| A. | ①②④ | B. | ①③④⑤ | C. | ②③⑤⑥ | D. | ④⑤⑥ |
| A. | 煤中含有苯及苯的同系物,可以通过干馏得到 | |
| B. | 煤是由有机物和无机物组成的复杂的混合物 | |
| C. | 乙烯是石油裂解后的产物 | |
| D. | 石油含有C5~C11的烷烃,可通过分馏得到汽油 |
将适量的0.1mol/L Fe(NO3)3溶液加入到新制备的银镜中,发现银镜溶解,同时无其它固体物质析出.
甲同学认为:Fe3+具有氧化性,能够溶解单质Ag.
乙同学认为:Fe(NO3)3溶液显酸性,该条件下NO3-也能氧化单质Ag.
(1)Fe(NO3)3溶液显酸性的原因Fe3++3H2O?Fe(OH)3+3H+.(请用离子方程式表述)
(2)乙同学设计下述实验以支持其观点,请填写如表内容
| 实验步骤(不要求写具体操作过程) | 预期现象和结论 |
| 步骤I: ① . 步骤II:配制与0.1 mol/L Fe(NO3)3 溶液所含c (H+)、 c (NO3-) 相同的溶液,取适量此溶液放入到新制备的银镜中. | ② ,乙同学的推测 成立;反之,则不成立. |
(4)丙同学进一步研究 Fe3+与Ag反应的程度.按如图连接装置并加入药品(盐桥中的物质不参与反应).

①K闭合时,指针向左偏转,石墨作正极(填“正极”或“负极”).
②当指针归零后,向左侧U型管中滴加几滴 FeCl2浓溶液,发现指针向右偏转,写出此时银电极的反应式Ag++eˉ=Ag.
③结合上述实验分析,写出Fe3+和Ag反应的离子方程式Fe3++Ag?Ag++Fe2+.
④丙同学进一步验证其结论:当指针归零后,向右侧U型管中滴加数滴饱和NaCl溶液,可观察到的现象是指针向左偏转.
| 序号 | 物质 | 杂质 | 所加试剂 | 分离方法 |
| (1) | NO | NO2 | ||
| (2) | Fe粉 | Al粉 | ||
| (3) | 氯化钠固体 | 氯化铵固体 | / |
| A. | 将作物秸秆通过化学反应转化为乙醇用作汽车燃料 | |
| B. | 使用资源节约型、环境友好型的生物降解塑料包装袋 | |
| C. | 大力研发新型有机溶剂替代水作为萃取剂 | |
| D. | 利用CO2合成聚碳酸酯类可降解塑料,实现“碳”的循环利用 |
 有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30).A的基态原子2p能级有3个单电子;C的基态原子2p能级有1个单电子;E原子最外层有1个单电子,其次外层有3个能级且均排满电子;D与E同周期,价电子数为2.则:
有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30).A的基态原子2p能级有3个单电子;C的基态原子2p能级有1个单电子;E原子最外层有1个单电子,其次外层有3个能级且均排满电子;D与E同周期,价电子数为2.则: