题目内容
20.下列物质按纯净物、混合物、强电解质、弱电解质、非电解质的组合正确的是( )| 选项 | 纯净物 | 混合物 | 强电解质 | 弱电解质 | 非电解质 |
| A | 食醋 | 胆矾晶体 | 纯碱 | 小苏打 | HD |
| B | 青铜 | 水煤气 | 硝酸 | 硫化氢 | 乙醇 |
| C | 烧碱 | 水玻璃 | 硫酸钡 | 一水合氨 | 液氨 |
| D | C12H22O11 | 铝热剂 | 三氧化硫 | 二氧化硫 | 二氧化硅 |
| A. | A | B. | B | C. | C | D. | D |
分析 依据由同种物质组成的为纯净物,包括单质和化合物;由不同物质组成的为混合物;在水溶液或熔融状态下能导电的化合物为电解质;在水溶液和熔融状态下都不能导电的化合物为非电解质,电解质和非电解质都是化合物来分析.
解答 解:A.食醋是醋酸的水溶液属于混合物,胆矾晶体是硫酸铜结晶水合物是纯净物,纯碱是碳酸钠、小苏打是碳酸氢钠,水溶液中完全电离是强电解质,HD为氢气单质既不是电解质也不是非电解质,故A错误;
B.青铜是合金属于混合物,水煤气是一氧化碳和氢气的混合气体属于混合物,硝酸是强酸属于强电解质,硫化氢是弱酸属于弱电解质,乙醇水溶液中和熔融状态下都不导电属于是非电解质,故B错误;
C.烧碱是氢氧化钠属于纯净物,水玻璃是硅酸钠的水溶液属于混合物,硫酸钡熔融状态完全电离属于强电解质,一水合氨是弱碱属于弱电解质,液氨本身不能电离出离子属于非电解质,故C正确;
D.C12H22O11、可能存在同分异构体,不一定是纯净物,铝热剂是铝和金属氧化物的混合物,三氧化硫、二氧化硫、二氧化硅本身不能电离出离子属于非电解质,故D错误.
故选C.
点评 本题考查了纯净物、混合物、电解质、非电解质的概念判断及各种物质的成分掌握,难度中等.

练习册系列答案
相关题目
10.HF气体分子间容易缔合.某HF气体由HF、(HF)2、(HF)3三者混合而成,其平均相对分子质量为42,则(HF)3的体积分数可能为( )
| A. | 51% | B. | 56% | C. | 57% | D. | 10% |
11.水溶液中能大量共存的一组离子是( )
| A. | NH4+ Ba2+ Cl- CO32- | B. | ClO- SO42- Fe2+ H+ | ||
| C. | K+ Na+ SO42- MnO4- | D. | Na+ H+ NO3-HCO3- |
8.硫酸亚铁是一种重要的化工原料,可以制备一系列物质(如图所示),下列说法错误的是( )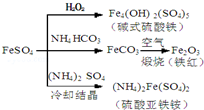

| A. | 碱式硫酸铁水解能产生Fe(OH)3胶体,可用作净水剂 | |
| B. | 为防止NH4HCO3分解,生产FeCO3需在较低温度下进行 | |
| C. | 可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化 | |
| D. | 常温下,(NH4)2Fe(SO4)2比FeSO4易溶于水 |
15.下列实验设计不能达到预期目的是( )
| 实验设计 | 预期目的 | |
| A | 在相同温度下,分别取等质量的大理石块、大理石粉末分别与等体积等浓度的稀硫酸反应 | 探究反应物接触面积对化学反应速率的影响 |
| B | 把盛有颜色相同的NO2和N2O4的混合气体的两支试管(密封)分别浸入冷水和热水中 | 探究温度对化学平衡的影响 |
| C | 反应Na2S2O3+H2SO4═Na2SO4+SO2+S↓+H2O,向甲试管中滴加5ml 0.05mol/L的Na2S2O3和5ml 0.02mol/LH2SO4,乙试管中滴加10ml 0.05mol/L的Na2S2O3和10ml 0.02mol/LH2SO4 | 探究浓度对化学平衡的影响 |
| D | 相同温度下,向两支盛有等体积等浓度H2O2溶液的试管中分别滴入适量的CuSO4溶液和FeCl3溶液 | 探究不同催化剂对同一反应速率的影响 |
| A. | A | B. | B | C. | C | D. | D |
9.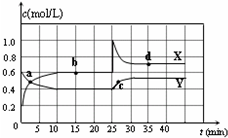 已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)△H<0.在恒温条件下将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,反应物浓度随时间变化关系如图.下列说法正确的是( )
已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)△H<0.在恒温条件下将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,反应物浓度随时间变化关系如图.下列说法正确的是( )
 已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)△H<0.在恒温条件下将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,反应物浓度随时间变化关系如图.下列说法正确的是( )
已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)△H<0.在恒温条件下将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,反应物浓度随时间变化关系如图.下列说法正确的是( )| A. | 图中Y曲线是表示NO2浓度随时间的变化曲线 | |
| B. | 前10 min内v(N2O4)为0.1 mol/( L•min) | |
| C. | 25 min时,导致平衡移动的原因是将密闭容器的体积缩小为1L | |
| D. | 25 min时,导致平衡移动的原因是向容器通入适量NO2 |
10.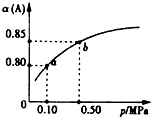 一定温度下,向容积为1L的密闭容器中加入0.5molA和0.25molB,发生反应:2A(g)+B(g)?2C(?),达到平衡时,放出热量Q1kJ.保持温度不变,A的平衡转化率(α)与体系总压强(p)的关系如图所示.则下列说法正确的是( )
一定温度下,向容积为1L的密闭容器中加入0.5molA和0.25molB,发生反应:2A(g)+B(g)?2C(?),达到平衡时,放出热量Q1kJ.保持温度不变,A的平衡转化率(α)与体系总压强(p)的关系如图所示.则下列说法正确的是( )
 一定温度下,向容积为1L的密闭容器中加入0.5molA和0.25molB,发生反应:2A(g)+B(g)?2C(?),达到平衡时,放出热量Q1kJ.保持温度不变,A的平衡转化率(α)与体系总压强(p)的关系如图所示.则下列说法正确的是( )
一定温度下,向容积为1L的密闭容器中加入0.5molA和0.25molB,发生反应:2A(g)+B(g)?2C(?),达到平衡时,放出热量Q1kJ.保持温度不变,A的平衡转化率(α)与体系总压强(p)的关系如图所示.则下列说法正确的是( )| A. | 若容器内气体的密度保持不变,说明反应一定达到平衡状态 | |
| B. | 若在相同条件下,改为只加入0.5 mol C,则反应达到平衡反,放出热量Q1kJ | |
| C. | 平衡状态由a变到b时,则化学平衡常数K(a)=K(b) | |
| D. | 由图象可知,产物C一定是气体 |