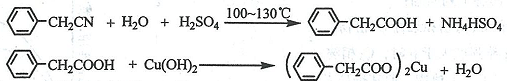题目内容
12.将3.9g镁铝合金,投入到500mL 2mol/L的盐酸中,合金完全溶解,再加入4mol/L的NaOH溶液,若要生成的沉淀最多,加入的这种NaOH溶液的体积是250mL.分析 镁铝合金与盐酸反应,金属完全溶解,生成氯化镁和氯化铝,加入4mol/L的NaOH溶液,生成的沉淀最多时,Mg2+和Al3+全部转化为沉淀,所以溶液中的溶质只有NaCl,根据氯原子和钠原子守恒可得n(NaOH)=n(NaCl)=n(HCl),进而计算需要氢氧化钠溶液体积.
解答 解:镁铝合金与盐酸反应,金属完全溶解,发生的反应为:Mg+2HCl=MgCl2+H2↑、2Al+6HCl=2AlCl3+3H2↑,Mg2+和Al3+全部转化为沉淀,分别与NaOH溶液反应的方程式为:AlCl3+3NaOH=Al(OH)3↓+3NaCl,MgCl2 +2NaOH=Mg(OH)2↓+2NaCl,所以溶液中的溶质只有NaCl,
根据氯原子和钠原子守恒,可得n(NaOH)=n(NaCl)=n(HCl)=2mol/L×0.5L=1mol,故需要氢氧化钠溶液体积=$\frac{1mol}{4mol/L}$=0.25L=250mL,
故答案为:250.
点评 本题考查混合物计算,难度中等,注意Mg2+和Al3+全部转化为沉淀时,NaOH不能过量,即氢氧化铝不能溶解,溶液中的溶质只有NaCl,注意利用原子守恒解题.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
3.下列说法正确的是( )
| A. | Na2O2中含有共价键,故是共价化合物 | |
| B. | 14C可用于文物年代的鉴定,14C与12C互为同素异形体 | |
| C. | ${\;}_{17}^{35}$Cl、${\;}_{17}^{37}$Cl为不同的核素,但化学性质几乎相同 | |
| D. | Fe(OH)3胶体是纯净物 |
20.下列物质按纯净物、混合物、强电解质、弱电解质、非电解质的组合正确的是( )
| 选项 | 纯净物 | 混合物 | 强电解质 | 弱电解质 | 非电解质 |
| A | 食醋 | 胆矾晶体 | 纯碱 | 小苏打 | HD |
| B | 青铜 | 水煤气 | 硝酸 | 硫化氢 | 乙醇 |
| C | 烧碱 | 水玻璃 | 硫酸钡 | 一水合氨 | 液氨 |
| D | C12H22O11 | 铝热剂 | 三氧化硫 | 二氧化硫 | 二氧化硅 |
| A. | A | B. | B | C. | C | D. | D |
7.铝在人体中积累可使人慢性中毒,铝在下列使用场合须加以控制的是:①制炊具 ②制易拉罐 ③制电线电缆 ④煎制油条时使用明矾 ⑤用明矾净水( )
| A. | ①②④⑤ | B. | 仅②⑤ | C. | 仅②④⑤ | D. | ③④⑤ |
17.分类法在化学研究中起到了非常重要的作用.下列对物质的分类不正确的组合是( )
| A. | 酸性氧化物:CO2、SO2、SiO2 | B. | 混合物:漂白粉、氨水、铝热剂 | ||
| C. | 电解质:氯气、硫酸钡、酒精 | D. | 同素异形体:C60、金刚石、石墨 |
1.下列关于反应能量的叙述正确的是( )
| A. | Zn(s)+CuSO4(aq)═ZnSO4(aq)+Cu(s)△H=-216 kJ•mol-1,反应物总能量<生成物总能量 | |
| B. | 相同条件下,1mol氢原子所具有的能量为E1,1mol氢分子的能量为E2,则2E1>E2 | |
| C. | 已知2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ•mol-1,H2的燃烧热为241.8kJ•mol-1 | |
| D. | H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1,含1molNaOH的NaOH溶液与含0.5molH2SO4的浓硫酸混合后放出57.3kJ的热量 |