��Ŀ����
����Ŀ�����������ʢ�ʯī�����ƣ��۾ƾ����ܰ����������⣻��̼�����ƹ��壻������������Һ���ി����������ƹ��壻��Һ̬�Ȼ��⡣
(1)�����ܵ������_______�����ڷǵ���ʵ���_________��
(2)�������ܺ͢�����ԭ�ӵ���Ŀ֮��Ϊ_____�����ܺ͢���������ԭ������ȣ���ܺ͢ݵ�����֮��Ϊ________��
(3)д���͢���ˮ��Һ�е����ӷ�Ӧ����ʽ____________________________��
(4)�����£�ij�ݻ��̶����ܱ������ɿ��ƶ��Ļ�������A��B�����ֱ���A��B���ҳ���H2��O2�Ļ�������1mol��������ʱ������λ����ͼ��ʾ��
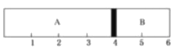
��A�һ������������������ԼΪ______________������ֵ��
��ʵ����A�һ�����������Ϊ34g����û��������ܶ���ͬ��ͬѹ�������ܶȵ�______����
������A��H2��O2�Ļ�������ȼ���ָ�ԭ�¶Ⱥ����ջ���ͣ����λ����______�̶ȴ���
(5)�ڱ�״���£�1L2mol/L����������Һ��ͨ��33.6L������̼�����ַ�Ӧ��������Һ���ʵijɷ���____________��
���𰸡��٢ڢ� �ۢ� 3:1 1:3 HCO3-+CH3COOH=CH3COO- +H2O+CO2�� 2NA����1.204��1024�� 8.5 2 Na2CO3�� NaHCO3
��������
(1)��ʯī�͢����������ƶ��ĵ��ӿ��Ե��磻������������Һ�п��������ƶ��������Ӻ������ӿ��Ե��硣�ǵ������������״̬��ˮ��Һ�ж�������Ļ�����۾ƾ��ܰ͢����Ƿǵ���ʣ�
(2)�������ܺ͢����ʵ���֮��Ϊ2:1����ԭ�ӵ���Ŀ֮��3��1�����ܺ͢���������ԭ������ȣ����ʵ���֮��Ϊ2:3����ܺ͢ݵ�����֮��Ϊ1:3��
(3)̼���������������ӷ���ʽ��HCO3-+CH3COOH=CH3COO- +H2O+CO2����
(4)�����£�ij�ݻ��̶����ܱ������ɿ��ƶ��Ļ�������A��B�����ֱ���A��B���ҳ���H2��O2�Ļ�������1mol��������ͼ��֪A��B�����2:1��A��B����ѹǿ���¶���ͬ����������ʵ���֮�ȵ��������֮�ȣ��Ƴ����ʵ�����Ϊ2:1������A�һ������������������ԼΪ2NA��
(5)ʵ����A�һ�����������Ϊ34g��A�����ʵ���Ϊ2mol����������ƽ��Ħ������17g/mol������Ħ������2g/mol����û��������ܶ���ͬ��ͬѹ�������ܶȵ�8.5����
(6)����A��H2��O2�Ļ�������ȼ����ˮ�����������ʵ���Ϊxmol���������ʵ���Ϊymol����x+y=2��2x+32y=34�����x=1��y=1����֪������ʣ�࣬ʣ������Ϊ1mol-1mol��0.5=0.5mol���ָ�ԭ�¶Ⱥ�����������ѹǿ��ȣ����֮�ȵ��������ʵ���֮�ȣ���A��B���ҵ����֮��Ϊ0.5mol��1mol=1��2�������ͣ����2�̶ȴ���
(7)�ڱ�״���£�1L2mol/L����������Һ��ͨ��33.6L������̼�����ַ�Ӧ�������������ʵ���2mol��������̼1.5mol�����ݻ�ѧ����ʽ2 NaOH + CO2= Na2CO3+ H2O������̼����0.5mol����������ӦNa2CO3+ H2O+ CO2=2 NaHCO3 ̼������ʣ�࣬������Һ���ʵijɷ���̼���ƺ�̼�����ơ�

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�