题目内容
5.元素周期表是学习物质结构与性质的重要工具.表是元素周期表的一部分,表中所列字母a、b、c、d、e、f、g、m、n、o、r分别代表某一种元素.请回答下列问题.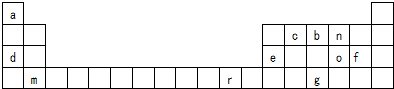
(1)g元素的原子序数为33;上述所给11种元素中非金属元素共有7种.
(2)m元素在元素周期表中的位置第四周期ⅡA族;e、n二元素形成的稳定化合物的化学式为Al2O3.
(3)o元素离子的电子式为
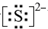 ;化合物ba3的结构式为
;化合物ba3的结构式为 .
.(4)用电子式表示化合物d2n的形成过程
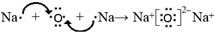 ;
;(5)d的最高价氧化物的水化物与e的最高价氧化物反应的离子方程式2OH-+Al2O3=2AlO2-+H2O.
(6)单质r与b的最高价氧化物的水化物的稀溶液反应的离子方程式3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O.
分析 由元素在周期表的位置可知,a为H,c为C,b为N,n为O,d为Na,e为Al,o为S,f为Cl,m为Ca,r为Cu,g为As,
(1)g为As,H、C、N、O、S、Cl、As为非金属;
(2)m为Ca,e、n二元素形成的稳定化合物为氧化铝;
(3)S离子的满足最外层8电子稳定结构;氨气为三角锥型;
(4)氧化钠为离子化合物;
(5)d的最高价氧化物的水化物为NaOH,e的最高价氧化物为氧化铝,二者反应生成偏铝酸钠和水;
(6)单质r为Cu,b的最高价氧化物的水化物的稀溶液为硝酸,二者反应生成硝酸铜、NO和水.
解答 解:由元素在周期表的位置可知,a为H,c为C,b为N,n为O,d为Na,e为Al,o为S,f为Cl,m为Ca,r为Cu,g为As,
(1)g为As,原子序数为33,H、C、N、O、S、Cl、As为非金属,共7种非金属元素,故答案为:33;7;
(2)m为Ca,在周期表的位置为第四周期ⅡA族,e、n二元素形成的稳定化合物为氧化铝,化学式为Al2O3,故答案为:第四周期ⅡA族;Al2O3;
(3)S离子的电子式为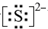 ;氨气为三角锥型,结构式为
;氨气为三角锥型,结构式为 ,故答案为:
,故答案为: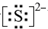 ;
; ;
;
(4)氧化钠为离子化合物,用电子式表示化合物d2n的形成过程为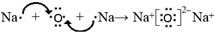 ,故答案为:
,故答案为: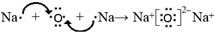 ;
;
(5)d的最高价氧化物的水化物为NaOH,e的最高价氧化物为氧化铝,二者反应生成偏铝酸钠和水,离子反应为2OH-+Al2O3=2AlO2-+H2O,
故答案为:2OH-+Al2O3=2AlO2-+H2O;
(6)单质r为Cu,b的最高价氧化物的水化物的稀溶液为硝酸,二者反应生成硝酸铜、NO和水,离子反应为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,
故答案为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、性质、元素周期律、元素化合物为解答的关键,侧重分析与应用能力的考查,注意化学用语的使用,题目难度不大.

 阅读快车系列答案
阅读快车系列答案【提出问题】生成物中有哪几种碳的氧化物?
【猜测】
| 猜想1 | 猜想2 | 猜想3 |
| 只有CO | 只有 | 含有CO和CO2 |

【实验探究】
(1)观察到装置A(填序号)中的澄清石灰水变浑浊,证明草酸分解有CO2气体生成.
(2)有两种实验现象都能分别证明草酸分解的气体中含有CO:
①C装置中澄清石灰水不变浑浊,F装置中澄清石灰水变浑浊;
②E装置中出现黑色粉末变成红色的现象.
【实验结论】通过实验探究证明:猜测3成立.
草酸分解的化学方程式是H2C2O4$\frac{\underline{\;\;△\;\;}}{\;}$CO↑+CO2↑+H2O.
【问题讨论】
(1)B装置的作用是除去气体中的二氧化碳,避免对气体中一氧化碳的检验造成干扰;D装置的作用是除去混合气中的水蒸气.
(2)装置末端酒精灯的作用是点燃尾气中一氧化碳,防止污染空气.
| A. | 质量数为19 | B. | 质子数为6 | C. | 中子数为7 | D. | 电子数为6 |
| A. | CH3CH2CH3 | B. | CH3CH(CH3)2 | C. | C (CH3)4 | D. | CH3CH2 CH2CH3 |
| A. | 乙烯和聚乙烯均能使溴水褪色 | |
| B. | 甲烷、苯和油脂均不能使酸性KMnO4溶液褪色 | |
| C. | 乙酸和乙酸乙酯均能发生取代反应 | |
| D. | 蔗糖和麦芽糖是同分异构体,均可以水解且产物相同 |

(1)【SO2的制备】:用亚硫酸钠与浓硫酸反应制备SO2的装置如图1(夹持仪器省略).图中的装置错误的是C(填字母);D的作用是吸收二氧化硫尾气,防止污染空气.
(2)【探究SO2的性质】:根据SO2中S元素的化合价,预测并通过实验验证SO2的性质.实验可选用的实验药品有浓硫酸、Na2SO3固体、Na2S溶液、FeCl3溶液、品红溶液等.探究过程实验装置如图2.(夹持仪器省略)
①请完成下列表格.
| 药品 | 作用 | |
| A | FeCl3溶液 | 验证SO2的还原性 |
| B | Na2S溶液 | 验证二氧化硫的氧化性 |
| C | 品红溶液 | 验证二氧化硫的漂白性 |
③在上述装置中通入过量的SO2,为了验证A中发生了氧化还原反应,取A中溶液分成两份,并设计了如下实验:
方案一:往第一份试液中加入少量酸性KMnO4溶液,紫红色褪去;
方案二:往第二份试液中加入KSCN溶液,不变红,再加入新制的氯水,溶液变红.
上述方案不合理的是方案一,原因是过量的二氧化硫能溶于水,也能使高锰酸钾褪色.
(3)【SO2的用途】:二氧化硫通常作为保护剂添加到葡萄酒中,有杀菌、抗氧化、改善风味和增酸的作用,但吸入过量二氧化硫对人体有害.我国国家标准规定葡萄酒中SO2的最大使用量为0.25g•L-1.图3为该小组对葡萄酒中的SO2进行收集与测量的装置.
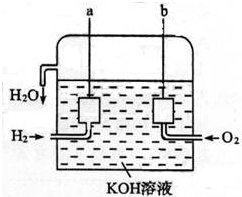
①冷凝管中水的进口为:a(填“a”或“b”)
②A中加入200.00ml葡萄酒和适量盐酸,加热使SO2全部逸出并与B中H2O2完全反应,其化学方程式为SO2+H2O2=H2SO4.
③除去B中过量的H2O2,然后用0.0600mol•L-1NaOH标准溶液进行滴定,滴定至终点时,消耗NaOH溶液20.00ml,该葡萄酒中SO2含量为:0.192g•L-1.
| A. | N2和H2 | B. | N2和H2O | C. | H2O | D. | N2 |