题目内容
14.将含有CO、H2、CO2和N2的混合气体,依次通过足量灼热的CuO、NaOH溶液、浓硫酸,最后剩下的气体是( )| A. | N2和H2 | B. | N2和H2O | C. | H2O | D. | N2 |
分析 CO、H2通过足量灼热的CuO发生氧化还原反应生成铜和二氧化碳、水,二氧化碳与足量氢氧化钠反应生成碳酸钠和水,现在的混合气体只有氮气和水蒸气,用浓硫酸干燥,最后得到的气体是氮气.
解答 解:第一阶段与CuO的反应:CO+CuO$\frac{\underline{\;高温\;}}{\;}$Cu+CO2,H2+2CuO$\frac{\underline{\;高温\;}}{\;}$H2O+2Cu,第二阶段与NaOH的反应:CO2+2NaOH=Na2CO3+H2O,第三阶段浓硫酸吸水,去除气体中的水蒸气,最后剩余化学性质最稳定的N2,故选D.
点评 本题考查混合气体的净化除杂,明确物质的性质是解题的关键,属于基础知识的考查,比较简单.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
4.已知:Ksp(AgCl)=1.8×10-10,Ksp(AgBr)=7.8×10-13.现将AgCl与AgBr的饱和溶液等体积混合,再加入足量浓AgNO3溶液,发生的反应为( )
| A. | 只有AgBr沉淀 | |
| B. | AgCl和AgBr沉淀等量生成 | |
| C. | AgCl和AgBr沉淀都有,但以AgCl沉淀为主 | |
| D. | AgCl和AgBr沉淀都有,但以AgBr沉淀为主 |
2.目前人类已发现的非金属元素除稀有气体外,共有16种.下列对这16种非金属元素的相关判断:①都是主族元素,最外层电子数都大于4;②单质在反应中都只能作氧化剂;③氢化物常温下都是气态,所以又都叫气态氢化物;④氧化物常温下都可以与水反应生成酸( )
| A. | 只有②③正确 | B. | 只有①③正确 | C. | 只有④正确 | D. | 均不正确 |
19.一定质量的铜在空气中加热后插入下列溶液中,质量不变的是( )
| A. | 石灰水 | B. | 硫酸 | C. | 硝酸 | D. | 乙醇 |
4.下列实验不能达到预期目的是( )
| 序号 | 实验操作 | 实验目的 |
| A | Cl2、Br2分别与H2反应 | 比较氯、溴的非金属强弱 |
| B | MgCl2、AlCl3溶液中分别通入NH3 | 比较镁、铝的金属性强弱 |
| C | 测定相同浓度H2CO3、H2SO4两溶液的pH | 比较碳、硫的非金属强弱 |
| D | Fe、Cu分别与盐酸反应 | 比较铁、铜的金属性强弱 |
| A. | A | B. | B | C. | C | D. | D |
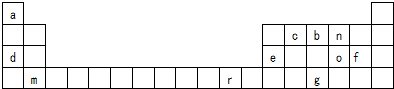
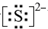 ;化合物ba3的结构式为
;化合物ba3的结构式为 .
.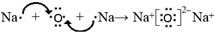 ;
;
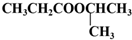 的合理可行的流程图,无机物质可任意选用.
的合理可行的流程图,无机物质可任意选用.