题目内容
(1)选择适宜的材料和试剂设计一个原电池,完成下列反应:Zn+CuSO4=ZnSO4+Cu画出装置图并标出电极材料和电解质溶液:
(2)用锌片、铜片连接后浸入稀硫酸溶液中,构成了原电池,工作一段时间,锌片的质量减少了3.25克,铜表面析出了氢气 L(标准状况下).导线中通过 mol电子.
(3)氢氧燃料电池一般是以惰性金属铂(Pt)或石墨做电极材料,负极通入H2,正极通入 O2,电解质是H2SO4溶液,回答:
①这种电极放电时发生的总反应式 .
②此电极的正极发生的电极反应是 .
③电解液中的H+离子向 极移动;向外电路释放电子的电极是 .
(2)用锌片、铜片连接后浸入稀硫酸溶液中,构成了原电池,工作一段时间,锌片的质量减少了3.25克,铜表面析出了氢气
(3)氢氧燃料电池一般是以惰性金属铂(Pt)或石墨做电极材料,负极通入H2,正极通入 O2,电解质是H2SO4溶液,回答:
①这种电极放电时发生的总反应式
②此电极的正极发生的电极反应是
③电解液中的H+离子向
考点:原电池和电解池的工作原理
专题:电化学专题
分析:(1)利用置换反应Zn+CuSO4=ZnSO4+Cu,说明Zn和Cu的金属活动性顺序,据此设计原电池时,根据反应可知,Zn为负极,则正极可以是活泼性不如Zn的金属如Cu等,也可以是碳棒,电解质溶液应为CuSO4,工作时,正极反应式为Cu2++2e-=Cu,有红色金属析出,负极反应式为Zn-2e-=Zn2+,Zn棒逐渐溶解;
(2)用锌片、铜片连接后浸入稀硫酸溶液中,构成了原电池,锌为负极,电极反应为:Zn-2e-=Zn2+;铜为正极,电极反应为2H++2e-=H2↑;根据两极转移电子数目相等计算;
(3)氢氧燃料电池的负极一定是氢气失电子的过程,在酸性环境下,氢气失电子成为氢离子,正极上一定是氧气得电子的过程,在酸性环境下成为水分子,电解质中的阳离子移向正极,阴离子移向负极,总反应是氢气和氧气之间反应生成水.
(2)用锌片、铜片连接后浸入稀硫酸溶液中,构成了原电池,锌为负极,电极反应为:Zn-2e-=Zn2+;铜为正极,电极反应为2H++2e-=H2↑;根据两极转移电子数目相等计算;
(3)氢氧燃料电池的负极一定是氢气失电子的过程,在酸性环境下,氢气失电子成为氢离子,正极上一定是氧气得电子的过程,在酸性环境下成为水分子,电解质中的阳离子移向正极,阴离子移向负极,总反应是氢气和氧气之间反应生成水.
解答:
解:(1)利用反应Zn+CuSO4=ZnSO4+Cu设计原电池时,根据反应可知,Zn为负极,则正极可以是活泼性不如Zn的金属如Cu等,也可以是碳棒,电解质溶液应为CuSO4,电池装置为: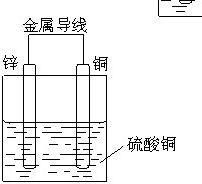 ,故答案为:
,故答案为: .
.
(2)用锌片、铜片连接后浸入稀硫酸溶液中,构成了原电池,锌为负极,电极反应为:Zn-2e-=Zn2+,铜为正极,电极反应为2H++2e-=H2↑,
锌片的质量减少了3.25克,则物质的量为
=0.05mol,转移的电子的物质的量为n(e-)=2n(Zn)=2n(H2)=2×0.05mol=0.1mol,则:V(H2)=0.05mol×22.4L/mol=1.12L,
故答案为:1.12L;0.1.
(3)①这种电极放电时发生的总反应式是氢气和氧气之间反应生成水的过程,即2H2+O2=2H2O,故答案为:2H2+O2=2H2O.
②正极上是氧气得电子的过程,电极反应式是O2+4e-+4H+=2H2O,故答案为:O2+4e-+4H+=2H2O;
③原电池中,电解质中的阳离子移向正极,阴离子移向负极,负极是失电子的极,故答案为:正;负极.
 ,故答案为:
,故答案为: .
.(2)用锌片、铜片连接后浸入稀硫酸溶液中,构成了原电池,锌为负极,电极反应为:Zn-2e-=Zn2+,铜为正极,电极反应为2H++2e-=H2↑,
锌片的质量减少了3.25克,则物质的量为
| 3.25g |
| 65g/mol |
故答案为:1.12L;0.1.
(3)①这种电极放电时发生的总反应式是氢气和氧气之间反应生成水的过程,即2H2+O2=2H2O,故答案为:2H2+O2=2H2O.
②正极上是氧气得电子的过程,电极反应式是O2+4e-+4H+=2H2O,故答案为:O2+4e-+4H+=2H2O;
③原电池中,电解质中的阳离子移向正极,阴离子移向负极,负极是失电子的极,故答案为:正;负极.
点评:本题考查了原电池中的工作原理及电极反应式的书写,难度不大,可以根据所学知识来回答,注意电子守恒的应用.

练习册系列答案
 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
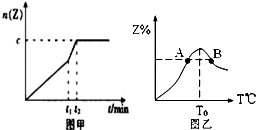 在一个体积为2L的恒容密闭容器中通入2molX(g)和1molY(g),发生反应:2X(g)+Y(g)?2Z(g);△H<0
在一个体积为2L的恒容密闭容器中通入2molX(g)和1molY(g),发生反应:2X(g)+Y(g)?2Z(g);△H<0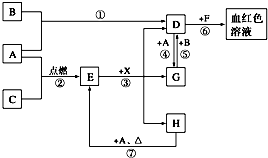 A、B、C为中学常见单质,其中一种为金属,通常情况下,A为固体,B为黄绿色气体,C为无色气体.D、E、F、G、H、X均为化合物,其中X常温下是无色气体,其水溶液是一种强酸,E为黑色固体,H在常温下为液体.它们之间的转化关系如下图所示(其中某些反应条件和部分反应物已略去).
A、B、C为中学常见单质,其中一种为金属,通常情况下,A为固体,B为黄绿色气体,C为无色气体.D、E、F、G、H、X均为化合物,其中X常温下是无色气体,其水溶液是一种强酸,E为黑色固体,H在常温下为液体.它们之间的转化关系如下图所示(其中某些反应条件和部分反应物已略去).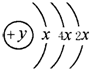 A、B、C、D四种短周期元素,原子序数D>A>B>C,且A、B同周期,C、D同主族,A的原子结构示意图如图,B元素最外层电子数是次外层电子数的四分之一,C元素的气态氢化物的水溶液显碱性,据此填空:
A、B、C、D四种短周期元素,原子序数D>A>B>C,且A、B同周期,C、D同主族,A的原子结构示意图如图,B元素最外层电子数是次外层电子数的四分之一,C元素的气态氢化物的水溶液显碱性,据此填空: )医学上又叫升白宁,对肿瘤患者化疗和放疗所致的白细胞减少症有较好的疗效.根据题意完成下列填空:
)医学上又叫升白宁,对肿瘤患者化疗和放疗所致的白细胞减少症有较好的疗效.根据题意完成下列填空: )与甲醇合成升白宁,该反应属于
)与甲醇合成升白宁,该反应属于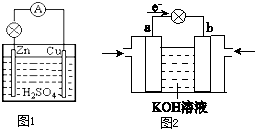 原电池是直接把化学能转化为电能的装置.
原电池是直接把化学能转化为电能的装置.