题目内容
5.某溶液中可能含有H+、Na+、NH4+、Fe3+、Al3+、SO42-、CO32-等离子.向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀物质的量随NaOH溶液的体积变化的图象如图所示.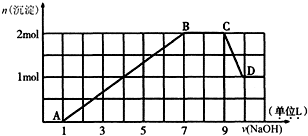
(1)A、B、C、D四点中沉淀成分相同的是B、C(写代号)
(2)由图象可推出原溶液中一定含有的离子有:H+、NH4+、Fe3+、Al3+、SO42-
(3)若要检验可能存在的离子应采取的方法是焰色反应
(4)原溶液中含有的Fe3+和Al3+的物质的量之比为1:1
(5)由图象计算使用的NaOH溶液的物质的量浓度是1mol/L.
分析 根据图象曲线变化可知,加入氢氧化钠溶液时没有立刻生成沉淀,说明溶液中含有H+;之后氢氧化钠溶液与金属离子反应生成沉淀,之后沉淀不变,最后沉淀部分溶解,则溶液中一定含有Fe3+、Al3+和NH4+,最终得到沉淀为氢氧化铁,沉淀溶解部分为氢氧化铝,沉淀不变的部分为铵根离子与氢氧根离子反应生成一水合氨;根据离子共存可知,溶液中一定不存在CO32-,结合溶液电中性可知,溶液中一定存在SO42-,以此解答该题.
解答 解:根据图象曲线变化可知,加入氢氧化钠溶液时没有立刻生成沉淀,说明溶液中含有H+;之后氢氧化钠溶液与金属离子反应生成沉淀,之后沉淀不变,最后沉淀部分溶解,则溶液中一定含有Fe3+、Al3+和NH4+,最终得到沉淀为氢氧化铁,沉淀溶解部分为氢氧化铝,沉淀不变的部分为铵根离子与氢氧根离子反应生成一水合氨;根据离子共存可知,溶液中一定不存在CO32-,结合溶液电中性可知,溶液中一定存在SO42-,
(1)由图象可知,开始生成Fe(OH)3沉淀,B、C为Fe(OH)3、Al(OH)3沉淀,D为Fe(OH)3沉淀,则A、B、C、D四点中沉淀成分相同的是B、C,故答案为:B、C;
(2)由以上分析可知原溶液中一定含有的离子有H+、NH4+、Fe3+、Al3+、SO42-,故答案为:H+、NH4+、Fe3+、Al3+、SO42-;
(3)不能确定是否含有Na+,如检验Na+,可利用焰色反应,钠的焰色反应为黄色,故答案为:焰色反应;
(4)根据图象曲线变化可知,剩余氢氧化铁沉淀的物质的量与溶解的氢氧化铝的物质的量相等,都为1mol,说明原溶液中含有的Fe3+和Al3+的物质的量之比为1:1,
故答案为:1:1;
(5)C~D发生Al(OH)3+NaOH=NaAlO2+2H2O,且由图象可知n(Al(OH)3)=1mol,则n(NaOH)=1mol,而体积为1L,则c(NaOH)=$\frac{1mol}{1L}$=1mol/L,
故答案为:1mol/L.
点评 本题考查无机物的推断,侧重考查离子反应的计算、离子共存的判断,为高频考点,题目难度中等,试题考查范围广,明确氢氧化铝是两性氢氧化物溶于强碱是解题关键.

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案| A. | 干冰、液态氯化氢都是电解质 | |
| B. | Na2O、Fe2O3、Al2O3既属于碱性氧化物,又属于离子化合物 | |
| C. | 有单质参加或生成的反应不一定属于氧化还原反应 | |
| D. | 根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体 |
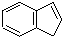 .下列关于茚的说法中不正确的是( )
.下列关于茚的说法中不正确的是( )| A. | 茚能使酸性高锰酸钾溶液褪色 | |
| B. | 茚能使溴的四氯化碳溶液褪色 | |
| C. | 1 mol茚只含有1 mol碳碳双键 | |
| D. | 茚中所有的原子均可能处在同一平面上 |
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 1 | ① | ② | ||||||
| 2 | ③ | ④ | ⑤ | ⑥ | ⑦ | |||
| 3 | ⑧ | ⑨ | ⑩ |
(2)最难形成简单离子的元素是He.
(3)单质具有半导体性质的元素是Si.
(4)元素的气态氢化物既不和所有的酸作用,又不和所有的碱作用的是C.
(5)能跟氙、氪形成二元化合物的元素是F.
(6)最新发现的一种单质是由60个原子组成球状结构的分子.这种单质叫足球烯,它是由C元素组成的.
(7)其单质能和冷水剧烈反应的元素是Na、F.
(8)a元素能以正化合价与b元素形成AB型化合物,该化合物常温下为固态且难溶于水,则a元素是Mg,b元素是O.

图1中的M是短周期金属元素,M的部分电离能如下表:
| I1 | I2 | I3 | I4 | I5 | |
| 电离能/kJ•mol-1 | 738 | 1451 | 7733 | 10540 | 13630 |
(1)Ti的基态原子外围电子排布式为4d25s2;
(2)M是Mg(填元素符号),该金属晶体的堆积模型为六方最密堆积,配位数为12;
(3)纳米TiO2是一种应用广泛的催化剂,纳米TiO2催化的一个实例如图2所示.化合物甲的分子中采取sp2方式杂化的碳原子有7个,化合物乙中采取sp3方式杂化的原子对应的元素的电负性由大到小的顺序为O>N>C;

(4)有一种氮化钛晶体的晶胞与NaCl晶胞相似,如图3所示,该晶胞中N、Ti之间的最近距离为a pm,则该氮化钛的密度为$\frac{4×62}{{N}_{A}×(2a×1{0}^{-10})^{3}}$ g•cm-3(NA为阿伏加德罗常数的值,只列计算式).该晶体中与N原子距离相等且最近的N原子有12个;
(5)科学家通过X-射线探明KCl、MgO、CaO、TiN的晶体与NaCl的晶体结构相似.且知三种离子晶体的晶格能数据如下:
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ•mol-1 | 786 | 715 | 3401 |
| A. | 0.80g | B. | 0.02g | C. | 0.23g | D. | 0.46g |
