题目内容
11.M是中药狼把草的成分之一,具有消炎杀菌作用,其结构如图所示.下列叙述正确的是( )
| A. | M的分子式为C9H10O4 | |
| B. | M与浓溴水既能发生取代反应,又能发生加成反应 | |
| C. | 一定条件下,1 mol M最多能与3molH2发生反应 | |
| D. | M能分别与Na、NaOH、NaHCO3发生反应 |
分析 由结构可知分子式,分子中含酚-OH、碳碳双键、-COOC-,结合酚、烯烃及酯的性质来解答.
解答 解:A.由结构可知M的分子式为C9H6O4,故A错误;
B.含-OH,酚-OH的邻位与溴水发生取代反应,含碳碳双键可发生加成反应,故B正确;
C.含苯环、碳碳双键与氢气发生加成反应,则一定条件下,1 mol M最多能与4molH2发生反应,故C错误;
D.含酚-OH,与Na、NaOH反应,故D错误;
故选B.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系、有机反应为解答的关键,侧重分析与应用能力的考查,注意酚、烯烃、酯的性质,题目难度不大.

练习册系列答案
 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案
相关题目
1.下列说法正确的是( )
| A. | 若把H2S分子写成H3S分子,违背了共价键的饱和性 | |
| B. | H3O+的存在,说明共价键没有饱和性 | |
| C. | 所有的共价键都有方向性 | |
| D. | 凡是有空轨道的微粒,都能接受孤电子对形成牢固的配位键 |
2.X、Y、Z、W四种常见元素,其中X、Y、Z为短周期元素,W为过渡元素,它们的相关信息如表:
回答下列问题:
(1)W在周期表的位置为第四周期第Ⅷ族,W(OH)2在空气中不稳定,极易被氧化反应的化学方程式为4Fe(OH)2+O2+2H2O═4Fe(OH)3.
(2)X的简单阴离子的结构示意图为 ;X的最高价氧化物对应水化物的水溶液与Y的氧化物反应的离子方程式为6H++Al2O3=2Al3++3H2O.
;X的最高价氧化物对应水化物的水溶液与Y的氧化物反应的离子方程式为6H++Al2O3=2Al3++3H2O.
(3)Z的氧化物在通讯领域的用途是光导纤维,工业上制备Z的单质的化学反应方程式为Ge+2 H2O2+2NaOH=Na2GeO3+3H2O.
(4)YX3固体在熔融状态下不导电,则YX3固体中存在共价键;在50mL l mol•L-1的YX3溶液中逐滴加入0.5mol•L-1的NaOH溶液,得到1.56g沉淀,则加入NaOH溶液的体积可能有二种情况.
| 原子或分子相关信息 | 单质及其化合物相关信息 | |
| X | ZX4分子是由粗Z提纯Z的中间产物 | X的最高价氧化物对应的水化物为无机酸中最强酸 |
| Y | Y原子的最外层电子数等于电子层数 | Y的氧化物是典型的两性氧化物,可用于制造一种高温材料 |
| Z | Z原子的最外层电子数是次外层电子数的$\frac{1}{2}$ | Z广泛存在于无机非金属材料中,其单质是制取大规模集成电路的主要原料 |
| W | W原子的最外层电子数小于4 | W的常见化合价有+3、+2,WX3稀溶液呈黄色 |
(1)W在周期表的位置为第四周期第Ⅷ族,W(OH)2在空气中不稳定,极易被氧化反应的化学方程式为4Fe(OH)2+O2+2H2O═4Fe(OH)3.
(2)X的简单阴离子的结构示意图为
 ;X的最高价氧化物对应水化物的水溶液与Y的氧化物反应的离子方程式为6H++Al2O3=2Al3++3H2O.
;X的最高价氧化物对应水化物的水溶液与Y的氧化物反应的离子方程式为6H++Al2O3=2Al3++3H2O.(3)Z的氧化物在通讯领域的用途是光导纤维,工业上制备Z的单质的化学反应方程式为Ge+2 H2O2+2NaOH=Na2GeO3+3H2O.
(4)YX3固体在熔融状态下不导电,则YX3固体中存在共价键;在50mL l mol•L-1的YX3溶液中逐滴加入0.5mol•L-1的NaOH溶液,得到1.56g沉淀,则加入NaOH溶液的体积可能有二种情况.
19.化学与生产、生活紧密相关,下列有关说法不正确的是( )
| A. | 人工合成的硅橡胶是目前最好的既耐高温又耐低温的橡胶 | |
| B. | 肥皂水显碱性,可用作蚊虫叮咬处的清洗剂 | |
| C. | 明矾净水是因为明矾水解产生的氢氧化铝胶体可以吸附水里悬浮的杂质 | |
| D. | 铝比铁更活泼,铁制品比铝制品更耐腐蚀 |
6.NA代表阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 6.4 g由S2、S4、S8组成的混合物含硫原子数为0.2NA | |
| B. | 将1 mol Cl2通入水中,HC1O、Cl-、ClO-粒子数之和为2NA | |
| C. | 标准状况下,44.8L NO与22.4 L O2反应后的分子数是2NA | |
| D. | 27g铝中加入1mol/L的NaOH溶液,转移电子数是3NA |
16.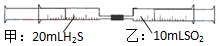 常温下,将甲针筒内20mLH2S推入含有10mLSO2的乙针筒内,一段时间后,对乙针筒内现象描述错误的是(气体在同温同压下测定)( )
常温下,将甲针筒内20mLH2S推入含有10mLSO2的乙针筒内,一段时间后,对乙针筒内现象描述错误的是(气体在同温同压下测定)( )
 常温下,将甲针筒内20mLH2S推入含有10mLSO2的乙针筒内,一段时间后,对乙针筒内现象描述错误的是(气体在同温同压下测定)( )
常温下,将甲针筒内20mLH2S推入含有10mLSO2的乙针筒内,一段时间后,对乙针筒内现象描述错误的是(气体在同温同压下测定)( )| A. | 有淡黄色固体生成 | B. | 有无色液体生成 | ||
| C. | 气体体积缩小 | D. | 最终约余15mL气体 |
10.甲醇是一种重要的化工原料,又是一种可再生能源,具有开发和应用的广阔前景.
(1)已知:
CH3OH(g)=HCHO(g)+H2(g)△H=+84kJ•mol-1
2H2(g)+O2(g)═2H2O(g)△H=-484kJ•mol-1
工业上常以甲醇为原料制取甲醛,请写出CH3OH(g)与O2(g)反应生成HCHO(g)和H2O(g)的热化学方程式:2CH3OH(g)+O2(g)=2HCHO(g)+2H2O(g)△H=-316 kJ•mol-1.
(2)工业上可用如下方法合成甲醇,化学方程式为CO(g)+2H2(g)?CH3OH(g),已知某些化学键的键能数据如表:
请回答下列问题
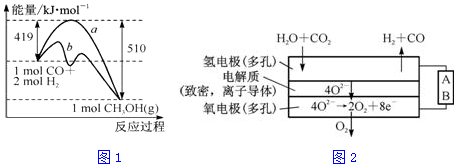
①该反应的△S<(填“>”或“<”)0.图1中曲线a到曲线b的措施是加入催化剂.
②已知CO中的C与O之间为三键,其键能为x kJ•mol-1,则x=1097.
(3)由甲醇、氧气和NaOH溶液构成的新型手机电池,可使手机连续使用一个月才充一次电.①该电池负极的电极反应式为CH3OH-6e-+8OH-=CO32-+6H2O.
②若以该电池为电源,用石墨作电极电解200mL含有如表离子的溶液.
电解一段时间后,当两极收集到相同体积(相同条件下)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象)阳极上收集到氧气的质量为3.2g.
(4)电解水蒸气和CO2产生合成气(H2+CO).较高温度下(700~1 000℃),在SOEC两侧电极上施加一定的直流电压,H2O和CO2在氢电极发生还原反应产生O2-,O2-穿过致密的固体氧化物电解质层到达氧电极,在氧电极发生氧化反应得到纯O2.由图2可知A为直流电源的负极(填“正极”或“负极”),请写出以H2O为原料生成H2的电极反应式:H2O+2e-=H2↑+O2-.
(1)已知:
CH3OH(g)=HCHO(g)+H2(g)△H=+84kJ•mol-1
2H2(g)+O2(g)═2H2O(g)△H=-484kJ•mol-1
工业上常以甲醇为原料制取甲醛,请写出CH3OH(g)与O2(g)反应生成HCHO(g)和H2O(g)的热化学方程式:2CH3OH(g)+O2(g)=2HCHO(g)+2H2O(g)△H=-316 kJ•mol-1.
(2)工业上可用如下方法合成甲醇,化学方程式为CO(g)+2H2(g)?CH3OH(g),已知某些化学键的键能数据如表:
| 化学键 | C-C | C-H | H-H | C-O | C≡O | O-H |
| 键能/kJ•mol-1 | 348 | 413 | 436 | 358 | x | 463 |

①该反应的△S<(填“>”或“<”)0.图1中曲线a到曲线b的措施是加入催化剂.
②已知CO中的C与O之间为三键,其键能为x kJ•mol-1,则x=1097.
(3)由甲醇、氧气和NaOH溶液构成的新型手机电池,可使手机连续使用一个月才充一次电.①该电池负极的电极反应式为CH3OH-6e-+8OH-=CO32-+6H2O.
②若以该电池为电源,用石墨作电极电解200mL含有如表离子的溶液.
| 离子 | Cu2+ | H+ | Cl- | SO42 - |
| c/mol•L-1 | 0.5 | 2 | 2 | 0.5 |
(4)电解水蒸气和CO2产生合成气(H2+CO).较高温度下(700~1 000℃),在SOEC两侧电极上施加一定的直流电压,H2O和CO2在氢电极发生还原反应产生O2-,O2-穿过致密的固体氧化物电解质层到达氧电极,在氧电极发生氧化反应得到纯O2.由图2可知A为直流电源的负极(填“正极”或“负极”),请写出以H2O为原料生成H2的电极反应式:H2O+2e-=H2↑+O2-.
11.可用来鉴别乙醇、乙醛的试剂是( )
| A. | 银氨溶液 | B. | 乙酸溶液 | C. | 氯化铁溶液 | D. | 氢氧化钠溶液 |