题目内容
NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A、2.8 g乙烯和丙烯的混合物中所含碳原子数为0.2NA |
| B、4.48 L H2和O2的混合物中所含分子数为0.2NA |
| C、4 g重水(D2O)中所含质子数为0.2NA |
| D、200 mL 1 mol/L的氨水中含NH3?H2O分子数为0.2NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、根据乙烯和丙烯的最简式为CH2来计算;
B、没有告诉在标准状况下,不能使用标况下的气体摩尔体积计算其物质的量;
C、质量换算物质的量结合分子式分析计算;
D、NH3?H2O是弱电解质,在水溶液中不完全电离.
B、没有告诉在标准状况下,不能使用标况下的气体摩尔体积计算其物质的量;
C、质量换算物质的量结合分子式分析计算;
D、NH3?H2O是弱电解质,在水溶液中不完全电离.
解答:
解:A、乙烯和丙烯的最简式为CH2,故2.8 g乙烯和丙烯的混合气体中含CH2的物质的量n=
=
=0.2mol,故含有的碳原子的物质的量为0.2mol,故A正确;
B、不是标况下,不能使用标况下的气体摩尔体积计算4.48L混合气体的物质的量,故B错误;
C、4g重水(D2O)物质的量为
=0.2mol,所含质子数为0.2mol×(1×2+8)×NA=2NA,故C错误;
D、NH3?H2O是弱电解质,在水溶液中不完全电离,200 mL 1 mol/L的氨水中含NH3?H2O分子数小于0.2NA,故D错误.
故选A.
| m |
| M |
| 2.8g |
| 14g/mol |
B、不是标况下,不能使用标况下的气体摩尔体积计算4.48L混合气体的物质的量,故B错误;
C、4g重水(D2O)物质的量为
| 4g |
| 20g/mol |
D、NH3?H2O是弱电解质,在水溶液中不完全电离,200 mL 1 mol/L的氨水中含NH3?H2O分子数小于0.2NA,故D错误.
故选A.
点评:本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
电池是人类生产和生活中的重要能量来源,各式各样电池的发展是化学对人类的一项重大贡献.下列有关电池的叙述正确的是( )
| A、锌锰干电池工作一段时间后碳棒不变 |
| B、燃料电池可将热能直接转变为电能 |
| C、燃料电池工作时燃料在负极被还原 |
| D、太阳能电池的主要材料是高纯度的二氧化硅 |
把0.05mol NaOH固体分别加入下列100mL液体中,溶液导电能力变化不大的是( )
| A、自来水 |
| B、0.5mol/L盐酸 |
| C、0.5mol/LCH3COOH |
| D、0.5mol/LNH4Cl溶液 |
已知下列热化学方程式:2Zn(s)+O2(g)=2ZnO(s);△H1=-702.2kJ/mol
2Hg(l)+O2(g)=2HgO(s);△H2=-181.4kJ/mol
由此可知热化学方程式Zn(s)+HgO(s)=ZnO(s)+Hg(l)的反应热△H3为( )
2Hg(l)+O2(g)=2HgO(s);△H2=-181.4kJ/mol
由此可知热化学方程式Zn(s)+HgO(s)=ZnO(s)+Hg(l)的反应热△H3为( )
| A、-441.8kJ/mol |
| B、-520.8kJ/mol |
| C、-883.6kJ/mol |
| D、-260.4kJ/mol |
下列化学用语书写正确的是( )
A、氯原子的结构示意图: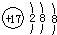 | ||
B、作为相对原子质量测定标准的碳核素:
| ||
C、氯化镁的电子式: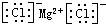 | ||
| D、乙烯的结构简式:CH2CH2 |
若NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A、2.3gNa在足量的O2中完全燃烧和与在空气中缓慢反应完全,转移的电子数均为0.1NA |
| B、11.2LCl2所含的原子数为NA |
| C、化学上定义12g碳中的碳原子数为NA的数值 |
| D、1L 0.10mol/L的CuSO4溶液中含Cu2+数目为0.1NA |
下列化学用语的表示,不正确的是( )
A、NaCl的电子式: |
B、Mg原子结构示意图: |
| C、乙烯的结构简式:CH2=CH2 |
D、甲烷的结构式: |