题目内容
17.下列叙述正确的是( )| A. | 用惰性电极电解某溶液时,若两极分别只有H2和O2生成,电解一段时间后,该溶液的浓度可能减小 | |
| B. | 电解精炼铜时,电解质溶液中铜离子浓度可能减小 | |
| C. | 原电池工作时,溶液中的阳离子向负极移动 | |
| D. | 要使电解后的CuSO4溶液复原,可向其中加人Cu(OH)2固体 |
分析 A.两极只有H2和O2生成,实质为电解水型;
B.电解精炼时,根据阴阳极上铜的质量变化判断溶液中铜离子浓度是否变化;
C.原电池工作时,溶液中的阳离子向正极移动,阴离子向负极移动;
D.电解质复原:出什么加什么,据此回答.
解答 解:A.两极只有H2和O2生成,实质为电解水型,该溶液的浓度可能增加,可能不变,不可能减小,故A错误;
B.电解精炼铜时,阳极上溶解的金属不仅有铜还有其它金属,阴极上只析出铜,所以溶解的铜小于析出的铜,导致溶液中铜离子浓度减小,故B正确;
C.原电池工作时,溶液中的阳离子向正极移动,阴离子向负极移动,故C错误;
D.电解CuSO4溶液的总反应为2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+2H2SO4+O2↑,电解放出或析出的是铜和氧气,此时若要恢复到电解前CuSO4溶液的浓度,所以需要加入氧化铜或者碳酸铜与硫酸反应即可,故D错误;
故选B.
点评 本题考查了原电池原理和电解池原理,易错选项是D,注意恢复溶液浓度需要加入从溶液中分离出的物质来组成,题目难度中等.

练习册系列答案
相关题目
7.短周期元素X和Y可组成化合物XY2,X的原子序数为a时,Y的原子序数可能为( )
①a+1 ②a+2 ③a+5 ④a-3 ⑤a-6 ⑥a-8.
①a+1 ②a+2 ③a+5 ④a-3 ⑤a-6 ⑥a-8.
| A. | ②③④⑤⑥ | B. | ②③④⑤ | C. | ①②③④⑤ | D. | ①②③④⑤⑥ |
8.某有机物如图.下列说法错误的是( )
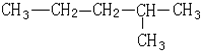
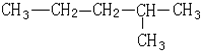
| A. | 该有机物属于烷烃 | |
| B. | 该烃与2,3-二甲基丁烷互为同系物 | |
| C. | 该烃的一氯取代产物共有5种 | |
| D. | 该有机物可由两种单炔烃分别与氢气加成得到 |
5.要想证明某溶液中是否含有Fe3+,下列操作中正确的是( )
| A. | 加入铁粉 | B. | 通入氯气 | C. | 加入铜片 | D. | 滴加KSCN溶液 |
9.下列化学用语表达不正确的是( )
| A. | 丙烷的球棍模型为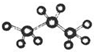 | B. | 丙烯的结构简式为CH3CHCH2 | ||
| C. | 符合通式CnH2n+2的一定是烷烃 | D. | O2、O3属于同素异形体 |
6.下列说法正确的是( )
| A. | 在常温下,浓硫酸不与铜反应,是因为铜被钝化 | |
| B. | 在BaC12溶液中通入SO2气体,溶液仍澄清,滴入3%过氧化氢溶液有白色沉淀 | |
| C. | 二氧化硫气体能用浓硫酸干燥,说明二氧化硫无还原性 | |
| D. | 硫在空气中的燃烧产物是二氧化硫,在纯氧中的燃烧产物是三氧化硫 |
7.如表各组物质中,不能按a→b→c关系相互转化的是(“→”表示一步完成)( )
| 选项 | a | b | c |
| A | Fe | FeCl3 | FeCl2 |
| B | Na | Na2O2 | NaOH |
| C | Si | SiO2 | H2SiO3 |
| D | HNO3 | NO | NO2 |
| A. | A | B. | B | C. | C | D. | D |
 .
.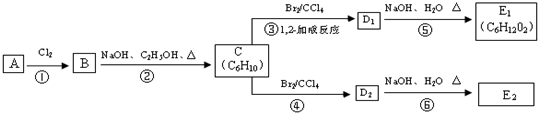
 ,C的化学名称是2,3-二甲基-1,3-丁二烯,反应⑥的化学方程式为
,C的化学名称是2,3-二甲基-1,3-丁二烯,反应⑥的化学方程式为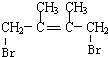 +2NaOH$→_{△}^{H_{2}O}$
+2NaOH$→_{△}^{H_{2}O}$ +2NaBr,④的反应类型是加成反应.
+2NaBr,④的反应类型是加成反应.