题目内容
7.短周期元素X和Y可组成化合物XY2,X的原子序数为a时,Y的原子序数可能为( )①a+1 ②a+2 ③a+5 ④a-3 ⑤a-6 ⑥a-8.
| A. | ②③④⑤⑥ | B. | ②③④⑤ | C. | ①②③④⑤ | D. | ①②③④⑤⑥ |
分析 短周期非金属元素X和Y能形成XY2型化合物,X、Y的化合价分别为+2、-1价时,可以分别在ⅡA、ⅦA(或Y为氢元素);X、Y的化合价分别为+4、-2价时可能均在ⅣA、ⅥA,还有可能为SO2、NO2、SCl2等,以此解答该题.
解答 解:①如为NO2,N的原子序数为7,O的为8,故正确;
②当X处于ⅣA族、Y处于ⅥA,若二者处于相同周期,Y的序数为a+2,如CO2,故正确;
③当X处于ⅡA族、Y处于ⅦA族,若二者处于相同周期,Y的序数为a+5,如MgCl2,故正确;
④若不同周期时,当Y为F元素,X处于第三周期,则Y的序数为a-3,故正确;
⑤若不同周期时,Y为O时,X处于第三周期,则Y的序数为a-6,如SiO2,故正确;
⑥分别为S、O,可组成化合物SO2,则Y的序数为a-8,故正确.
故选D.
点评 本题考查周期表的结构及应用,为高频考点,把握原子序数判断元素为解答的关键,侧重分析与应用能力的考查,注意常见化合物组成,题目难度不大.

练习册系列答案
 快乐5加2金卷系列答案
快乐5加2金卷系列答案
相关题目
16.医学研究证明,用放射性${\;}_{53}^{135}$Ⅰ治疗肿瘤可收到一定疗效,下列有关${\;}_{53}^{135}$Ⅰ的叙述正确的是( )
| A. | 核内的中子数为53 | |
| B. | 核内的电子数为135 | |
| C. | 核内的中子数与核外电子数之差为29 | |
| D. | 质量数为82 |
2.在标准状况下进行甲、乙、丙三组实验,三组各取30mL同浓度的盐酸溶液,加入同一种镁铝合金粉末,产生气体,有关数据列表如下:
(1)甲组实验中,盐酸过量 (填“过量”“适量”或“不足量”),乙组实验中,盐酸不足量(填“过量”“适量”或“不足量”).参考合适的数据计算出盐酸的物质的量浓度为1mol/L.
(2)参考合适的数据组合求得的Mg、Al的物质的量之比为1:1.
(3)在丙组实验之后,向容器中加入1mol•L-1的氢氧化钠溶液,能使合金中的铝恰好溶解,不形成含铝的沉淀,并使Mg2+刚好沉淀完全,再过滤出不溶固体,求滤液中各溶质的物质的量和所加入氢氧化钠溶液的体积.
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量(mg) | 255 | 385 | 459 |
| 生成气体体积(mL) | 280 | 336 | 336 |
(2)参考合适的数据组合求得的Mg、Al的物质的量之比为1:1.
(3)在丙组实验之后,向容器中加入1mol•L-1的氢氧化钠溶液,能使合金中的铝恰好溶解,不形成含铝的沉淀,并使Mg2+刚好沉淀完全,再过滤出不溶固体,求滤液中各溶质的物质的量和所加入氢氧化钠溶液的体积.
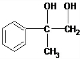
12.某有机物的结构简式为 ,它在一定条件下能发生的反应有①加成反应 ②水解反应 ③酯化反应 ④氧化反应 ⑤中和反应 ⑥消去反应( )
,它在一定条件下能发生的反应有①加成反应 ②水解反应 ③酯化反应 ④氧化反应 ⑤中和反应 ⑥消去反应( )
 ,它在一定条件下能发生的反应有①加成反应 ②水解反应 ③酯化反应 ④氧化反应 ⑤中和反应 ⑥消去反应( )
,它在一定条件下能发生的反应有①加成反应 ②水解反应 ③酯化反应 ④氧化反应 ⑤中和反应 ⑥消去反应( )| A. | ②③④ | B. | ①③④⑤ | C. | ①③⑤⑥ | D. | ②③④⑤⑥ |
16.短周期元素X、Y、Z、Q在元素周期表中的相对位置如图,地壳中含量最高的元素已包含其中.回答下列问题:
(1)Q在元素周期表中的位置是第二周期VIA族.X离子的结构示意图为 .
.
(2)下列选项中,能证明元素非金属性Z强于Y的是C.
A.反应中,Y原子得到的电子数比Z原子得到的电子数多
B.最高正价,Z比Y的高
C.最高价氧化物的水化物酸性:Z>Y
(3)ZQ2是国际公认高效安全杀菌消毒剂,已知ZQ2可将弱酸性废水中的Mn2+转化为MnO2而除去,同时ZQ2被还原为Z-,该反应的离子方程式为5Mn2++2ClO2+6H2O=5MnO2↓+2Cl-+12H+.
(4)H元素与Y形成的化合物中二者的质量之比是1:3,已知常温下4g该化合物完全燃烧并恢复到原来温度时放出222.6kJ热量,则表示该化合物燃烧热的热化学方程式为CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.4kJ/mol.
(5)表中X的最高价氧化物对应水化物的化学式为X(OH)n,在25℃时,其饱和溶液能使酚酞试液变红,则其饱和溶液中的pH=10.3(已知:25℃,Ksp[X(OH)n]=4.0×l0-12;lg5=0.7).
| Y | Q | ||||
| X | Z |
 .
.(2)下列选项中,能证明元素非金属性Z强于Y的是C.
A.反应中,Y原子得到的电子数比Z原子得到的电子数多
B.最高正价,Z比Y的高
C.最高价氧化物的水化物酸性:Z>Y
(3)ZQ2是国际公认高效安全杀菌消毒剂,已知ZQ2可将弱酸性废水中的Mn2+转化为MnO2而除去,同时ZQ2被还原为Z-,该反应的离子方程式为5Mn2++2ClO2+6H2O=5MnO2↓+2Cl-+12H+.
(4)H元素与Y形成的化合物中二者的质量之比是1:3,已知常温下4g该化合物完全燃烧并恢复到原来温度时放出222.6kJ热量,则表示该化合物燃烧热的热化学方程式为CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.4kJ/mol.
(5)表中X的最高价氧化物对应水化物的化学式为X(OH)n,在25℃时,其饱和溶液能使酚酞试液变红,则其饱和溶液中的pH=10.3(已知:25℃,Ksp[X(OH)n]=4.0×l0-12;lg5=0.7).
17.下列叙述正确的是( )
| A. | 用惰性电极电解某溶液时,若两极分别只有H2和O2生成,电解一段时间后,该溶液的浓度可能减小 | |
| B. | 电解精炼铜时,电解质溶液中铜离子浓度可能减小 | |
| C. | 原电池工作时,溶液中的阳离子向负极移动 | |
| D. | 要使电解后的CuSO4溶液复原,可向其中加人Cu(OH)2固体 |

 ,F
,F .
. +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2 +2H2O.
+2H2O.