题目内容
3.取相同体积的FeBr2、KI、Na2S溶液,分别通入足量的Cl2,当反应恰好完成时,同温同压条件下消耗Cl2的体积相同,则FeBr2、KI、Na2S溶液的物质的量浓度之比是( )| A. | 2:1:1 | B. | 2:6:3 | C. | 3:2:1 | D. | 1:3:2 |
分析 首先,写出相关化学方程式2KI+Cl2═2KCl+I2 Na2S+Cl2═2NaCl+S↓ 2FeBr2+3Cl2═2FeCl3+2Br2,求出在相同在Cl2相等的情况下,KI、Na2S、FeBr2的物质的量之比,而三种溶液体积有相等,物质的量浓度之比就等于物质的量之比.
解答 解:由三个反应2KI+Cl2═2KCl+I2 Na2S+Cl2═2NaCl+S↓ 2FeBr2+3Cl2═2FeCl3+2Br2,可设消耗氯气的物质的量为:3mol,
则由化学方程式2FeBr2+3Cl2═2FeCl3+2Br2 、2KI+Cl2═2KCl+I2、Na2S+Cl2═2NaCl+S↓,所以FeBr2、KI、Na2S的物质的量分别为:2mol、6mol、3mol,
可知在Cl2相等的情况下,FeBr2、KI、Na2S的物质的量之比为2:6:3,在三种溶液体积相等的前提下,物质的量浓度之比就等于物质的量之比.
故选:B.
点评 本题主要考查有关化学方程式的计算和物质的量的计算,难度较小.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
13.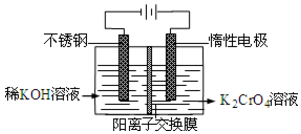 以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图如下:下列说法不正确的是( )
以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图如下:下列说法不正确的是( )
 以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图如下:下列说法不正确的是( )
以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图如下:下列说法不正确的是( )| A. | 在阴极式,发生的电极反应为:2H2O+2e-=2OH-+H2↑ | |
| B. | 在阳极室,通电后溶液逐渐由黄色变为橙色,是因为阳极区H+浓度增大,使平衡2CrO42-+2H+?Cr2O72-+H2O向右移动 | |
| C. | 该制备过程总反应的化学方程式为:4K2CrO4+4H2O$\frac{\underline{\;通电\;}}{\;}$2K2Cr2O7+4KOH+2H2↑+2O2↑ | |
| D. | 测定阳极液中K和Cr的含量,若K与Cr的物质的量之比为d,则此时铬酸钾的转化率为α=$\frac{d}{2}$ |
14.已知某有机物A的核磁共振氢谱如图所示,下列说法中错误的是( )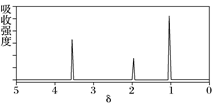

| A. | 若A的分子式为C3H6O2,则其结构简式为CH3COOCH3 | |
| B. | 由核磁共振氢谱可知,该有机物分子中有三种不同化学环境的氢原子,且个数之比为1:2:3 | |
| C. | 仅由其核磁共振氢谱无法得知其分子中的氢原子总数 | |
| D. | 若A的化学式为C3H6O2,则其同分异构体有三种 |
11.下列有关仪器的使用正确的是( )
| A. | 手持试管给试管内的物质加热 | |
| B. | 用燃着的酒精灯去点燃另一盏酒精灯 | |
| C. | 用天平称量药品时用手直接拿砝码 | |
| D. | 蒸馏操作时冷凝管中冷却水应该从下方通入,从上方流出 |
8.下列叙述中,正确的是( )
| A. | 将一小块金属钠投入稀硫酸铜溶液中会有红色固体析出 | |
| B. | 向0.4mol浓盐酸中加入足量的MnO2,加热,可收集(标准状况下)2.24LCl2 | |
| C. | 向足量的盐酸和氢氧化钠溶液中各加入等质量的Al粉,消耗盐酸与氢氧化钠溶液的物质的量之比为3:1 | |
| D. | 150 mL 1 mol•L-1NaCl溶液与75 mL 1 mol•L-1 Na2CO3溶液中Na+物质的量浓度相等 |
15.已知Na2SO4和NaCl混合溶液中,Cl-的物质的量浓度是Na+的物质的量浓度的$\frac{3}{5}$倍,下列叙述中正确的是( )
| A. | Na2SO4和NaCl的物质的量之比为1:3 | |
| B. | 溶液中一定有1molNa2SO4和3molNaCl | |
| C. | 所得电荷数SO42-是Na+的0.4倍 | |
| D. | SO42-与Cl-的物质的量之和等于Na+的物质的量 |
12.关于元素周期表的说法正确的是( )
| A. | 第三周期有8种元素 | |
| B. | 短周期元素是指第一、二周期所含有的全部元素 | |
| C. | 元素周期表有8个主族 | |
| D. | IA族中的元素全部是金属元素 |
13.下列说法正确的是( )
| A. | 乙酸乙酯中是否混有乙酸,可以加石蕊试液进行检测 | |
| B. | 乙醇中是否混有乙酸,可以加入金属钠进行检验 | |
| C. | 乙酸乙酯、乙酸均能与NaOH反应,二者分子中的官能团相同 | |
| D. | 淀粉和蛋白质均可水解生成葡萄糖 |