题目内容
1. (1)铁及其化合物在生活、生产中有广泛应用.请回答下列问题:
(1)铁及其化合物在生活、生产中有广泛应用.请回答下列问题:①黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料.其中一个反应为3FeS2+8O2$\frac{\underline{\;高温\;}}{\;}$6SO2+Fe3O4,氧化产物为SO2和Fe3O4,若有3mol FeS2参加反应,转移32mol电子.
②与明矾相似,硫酸铁也可用作净水剂,其原理为:Fe3++3H2O?Fe(OH)3+3H+(用离子方程式表示).
③FeC13与氢碘酸反应时可生成棕色物质,该反应的离子方程式为2Fe3++2I-=2Fe2++I2.
(2)己知:S2O32-具有较强的还原性,实验室可用I-测定K2S2O8样品的纯度,反应方程式为:
S2O82-+2I-═2SO42-+I2 ①I2+2S2O32-═2I-+S4O62-②S2O82-、S4O62-、I2氧化性强弱顺序S2O82->I2>S4O62-.
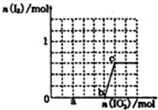
(3)己知溶液中,还原性为HSO3->I-,氧化性为IO3->I2>SO42-.在含3mol NaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示.
①a点处的还原产物是:I-(填离子符号);
b点→c点反应的离子方程式是IO3-+6H++5I-=3H2O+3I2.
②当溶液中的I-为0.5mol时、加入的KI03可能是0.5或1.1mol.
分析 (1)①反应3FeS2+8O2=Fe3O4+6SO2中Fe元素化合价又+2→+3,化合价升高,S元素化合价由-1→+4,化合价升高,O元素化合价由0→-2,化合价降低;
②三价铁离子水解生成氢氧化铁胶体和氢离子;
③三价铁离子与碘离子反应生成亚铁离子和单质碘;
(2)反应方程式为S2O82-+2I-═2SO42-+I2①、I2+2S2O2-3═2I-+S4O62-②,根据氧化剂的氧化性大于氧化产物的氧化性分析;
(3)还原性HSO-3>I-,首先发生反应:IO3-+3HSO3-═I-+3SO42-+3H+,HSO3-反应完毕,继续加入KIO3,由于氧化性IO-3>I2,再发生反应:IO3-+6H++5I-=3H2O+3I2,
①结合图中a点碘的量判断发生的反应,所含元素化合价降低的元素被还原生成还原产物,据此解答;由图可知,b点到c点有碘生成,应发生IO3-+6H++5I-=3H2O+3I2;
②当溶液中的I-为0.5mol时,有两种情况:
一是只发生反应IO3-+3HSO3-═I-+3SO42-+3H+,生成I-为0.5mol,根据碘元素守恒n(KIO3)=n(I-);
二是HSO3-反应完毕后,还发生IO3-+6H++5I-=3H2O+3I2,剩余I-为0.5mol,计算HSO3-反应完毕生成n(I-)、消耗的n(KIO3),进而计算反应IO3-+6H++5I-=3H2O+3I2中消耗的I-、KIO3的物质的量,据此计算
解答 解:①反应3FeS2+8O2=Fe3O4+6SO2,前后各元素化合价的变化情况如下:
Fe:+2→+3,化合价升高;S:-1→+4,化合价升高;O:0→-2,化合价降低;
因此,在反应中FeS2还原剂,O2是氧化剂,Fe3O4既是氧化产物也是还原产物,SO2既是氧化产物也是还原产物;在上述反应中共转移32个电子,有3molFeS2参加反应,转移电子的物质的量为32mol,
故答案为:SO2和Fe3O4;32.
②与明矾相似,硫酸铁也可用作净水剂,三价铁离子水解生成氢氧化铁胶体和氢离子,离子方程式:Fe3++3H2O?Fe(OH)3+3H+;
故答案为:Fe3++3H2O?Fe(OH)3+3H+;
③三价铁离子与碘离子反应生成亚铁离子和单质碘,反应的离子方程式:2Fe3++2I-=2Fe2++I2;
故答案为:2Fe3++2I-=2Fe2++I2;
(2)反应方程式为S2O82-+2I-═2SO42-+I2①、I2+2S2O2-3═2I-+S4O62-②,根据氧化剂的氧化性大于氧化产物的氧化性,可知氧化性:S2O82->I2>S4O62-;
故答案为:S2O82->I2>S4O62-;
(3)还原性HSO-3>I-,首先发生反应:IO3-+3HSO3-═I-+3SO42-+3H+,HSO3-反应完毕,继续加入KIO3,由于氧化性IO-3>I2,再发生反应:IO3-+6H++5I-=3H2O+3I2,
①由图可知,a点没有生成碘,故发生反应IO3-+3HSO3-═I-+3SO42-+3H+,I元素的化合价降低,生成I-为还原产物,b点到c点由于生成I2,故发生反应:IO3-+6H++5I-=3H2O+3I2,
故答案为:I-;IO3-+6H++5I-=3H2O+3I2;
②当溶液中的I-为0.5mol时,有两种情况:
一是只发生反应IO3-+3HSO3-═I-+3SO42-+3H+,生成I-为0.5mol,根据碘元素守恒n(KIO3)=n(I-)=0.5mol;
二是HSO3-反应完毕后,还发生IO3-+6H++5I-=3H2O+3I2,剩余I-为0.5mol,3molNaHSO3消耗1molKIO3、生成1molI-,故反应IO3-+6H++5I-=3H2O+3I2中消耗的I-为1mol-0.5mol=0.5mol,消耗KIO3的物质的量为0.5mol×$\frac{1}{5}$=0.1mol,故共加入的KIO3为1mol+0.1mol=1.1mol,
故答案为:0.5或1.1.
点评 本题综合考查氧化还原反应、元素化合物知识、离子方程式的书写等,为高频考点,侧重学生的分析、计算能力的考查,注意把握物质的性质和氧化还原反应的有关知识,难度中等.

 智慧小复习系列答案
智慧小复习系列答案| A. | 用酸性KMnO4溶液鉴别乙烯和乙醇 | |
| B. | 将乙烷与溴水混合光照制溴乙烷 | |
| C. | 苯和硝基苯的混合物采用分液的方法分离 | |
| D. | 可用CCl4萃取碘水中的碘 |

| A. | 该混合物一定是K2CO3和NaCl | B. | 该混合物可能是Na2CO3和KCl | ||
| C. | 该混合物可能是Na2SO4和Na2CO3 | D. | 该混合物一定是Na2CO3和NaCl |
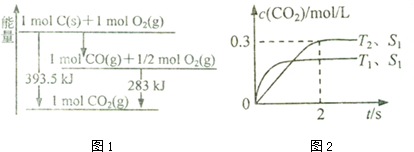
(1)已知一定量的C单质能在O2(g)中燃烧,其可能的产物及能量关系如图1所示:写出CO(g)生成CO2(g)与C(s)反应的热化学方程式2CO(g)=CO2(g)+C(s)△H=-172.5kJ/mol.
(2)工业用CO制备氢气的一种方法为:C0(g)+H20(g)=molfCO2(g)+H2(g)
| t/min | 0 | 1 | 2 | 3 | 4 |
| n(H20)/mol | 0.60 | 0.50 | 0.44 | 0.40 | 0.40 |
| n(CO)/mol | 0.40 | 0.30 | 0.24 | 0.20 | 0.20 |
则该温度下反应的平衡常数K=0.5;
②相同温度下,若向2L恒容密闭容器中充入1mol CO、4mol H20(g)、2mol C02、2mol H2,
此时v正< v逆.(填“>”、或“<”)
(3)汽车尾气净化的主要原理为:2NO(g)+2CO(g) $\stackrel{催化剂}{?}$2C02(g)+N2(g)△<0
在密闭容器中发生该反应时,c(C02)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图2所示.
①在T2温度下,0〜2s内的平均反应速率v(N2)=0.075mol/(L•s)
能使上述平衡体系中$\frac{n(C{O}_{2})}{n(CO)}$ 增大的措施有降温、加压或增大CO的物质的量或将N2从体系中分离 (任写一条).
②向某密闭恒容容器中按体积比1:1充入44.8L (标准状况)NO和CO混合气体,发生
上述反应,下列各项能判断该反应t=10min时反应达到平衡的是BD.(填序号字母)
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为K=$\frac{c(CO)c({H}_{2}O)}{c(C{O}_{2})c({H}_{2})}$
(2)该反应为吸热反应(选填“吸热”“放热”).
(3)能判断该反应是否达到化学平衡状态的依据是BC.
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O) D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合c(CO2)•c(H2)=c(CO).c(H2O),试判断此时的温度为830℃.在此温度下2L密闭容器中进行反应CO2(g)+H2(g)?CO(g)+H2O(g),CO2(g)和H2(g)的起始量均为2.0mol,达到平衡时CO2的转化率为50%,CO的平衡浓为0.5mol/L.
(5)在密闭容器中进行反应①Fe(s)+CO2(g)?FeO(s)+CO(g)△H1=akJ•mol-1
反应②2CO(g)+O2(g)?2CO2(g)△H2=b kJ•mol-1
反应③2Fe(s)+O2(g)?2FeO(s)△H3
则△H3=(2a+b)kJ/mol(用含a、b的代数式表示).
| 选项 | 变化过程 | 现象 |
| A | 将少量酚酞滴加到过氧化钠固体上 | 变红 |
| B | 将过量氯气通入紫色石蕊试液中 | 褪色 |
| C | 过量氨水逐滴加入氯化铝溶液中 | 先产生白色沉淀后白色沉淀消失 |
| D | 氢氧化铁胶体中加入过量稀硫酸 | 先产生红褐色沉淀后溶解,溶液变为黄色 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 乙醇的结构简式为CH3CH2OH,分子式为C2H5OH | |
| B. | 乙酸的电离方程式为CH3COOH=CH3COO-+H+ | |
| C. | 中子数为16的磷原子可表示为${\;}_{15}^{31}$P | |
| D. | S2-结构示意图为 |
| A. | 光导纤维是信息社会必不可少的有机合成材料 | |
| B. | 棉布、羊毛和涤纶燃烧后都只生成二氧化碳和水 | |
| C. | 储热材料是一类重要的能量存储物质,单位质量的储热材料在发生熔融或结晶时会吸收或释放较多的热量 | |
| D. | 煤经过气化和液化等物理变化可转化为清洁燃料 |