题目内容
CO可用于合成甲醇.在压强为0.1Mpa条件下,在体积为bL的密闭容器中充入amolCO和2amolH2,在催化剂作用下合成甲醇:
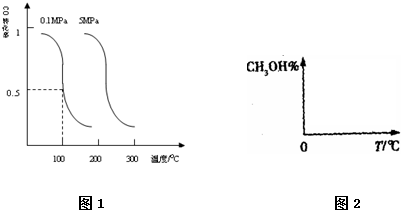
CO(g)+2H2(g)?CH3OH(g)平衡时CO的转化率与温度,压强的关系如图1
①该反应的△H 0(填“<”“>”或“=”).
②l00℃时该反应的平衡常数K= (用含a、b的代数式表示).
③在温度容积不变的情况下,向该密闭容器再增加a mol CO与2a mol H2,达到新平衡时,CO的转化率 (填“增大”“减小”或“不变”),平衡常数 (填“增大”“减小”或“不变”).
④请在图2中画出平衡时甲醇的百分含量(纵坐标)随温度(横坐标)“的变化曲线,要求画出压强不同的两条曲线(在曲线上标出p1、p2,且p1<p2)
CO(g)+2H2(g)?CH3OH(g)平衡时CO的转化率与温度,压强的关系如图1
①该反应的△H
②l00℃时该反应的平衡常数K=
③在温度容积不变的情况下,向该密闭容器再增加a mol CO与2a mol H2,达到新平衡时,CO的转化率
④请在图2中画出平衡时甲醇的百分含量(纵坐标)随温度(横坐标)“的变化曲线,要求画出压强不同的两条曲线(在曲线上标出p1、p2,且p1<p2)

考点:有关反应热的计算,化学平衡常数的含义,化学平衡的影响因素
专题:化学平衡专题
分析:①由图可知,压强一定时,随温度升高,CO的转化率降低,故升高温度平衡向逆反应移动,据此判断;
②化学平衡常数K=
,根据CO的转化率,利用三段式计算出平衡时各组分的物质的量,进而求出平衡时各组分的浓度,代入平衡常数计算;
③在温度和容积不变的情况下,再向平衡体系中充入a mol CO(g)、2a mol H2(g),等效为在原平衡的基础上增大一倍压强,平衡向正反应移动;
化学平衡常数只受温度影响,与浓度无关,温度不变,平衡常数不变;
④根据压强对平衡移动的影响判断;
②化学平衡常数K=
| c(CH3OH) |
| c(CO)c2(H2) |
③在温度和容积不变的情况下,再向平衡体系中充入a mol CO(g)、2a mol H2(g),等效为在原平衡的基础上增大一倍压强,平衡向正反应移动;
化学平衡常数只受温度影响,与浓度无关,温度不变,平衡常数不变;
④根据压强对平衡移动的影响判断;
解答:
解:①由图可知,压强一定时,随温度升高,CO的转化率降低,故升高温度平衡向逆反应移动,则正反应为放热反应,△H<0;
故答案为:<;
②100℃,平衡时CO的转化率为0.5,所以参加反应的CO的物质的量为0.5amol.
CO(g)+2H2(g)?CH3OH(g);
开始(mol):a 2a 0
变化(mol):0.5a a 0.5a
平衡(mol):0.5a a 0.5a
所以平衡时,CO的浓度为
=
mol/L,H2的浓度为
=mol/L,CH3OH的浓度为
=
mol/L,100℃时该反应的平衡常数K=
═
=
,
故答案为:
;
③在温度和容积不变的情况下,再向平衡体系中充入a mol CO(g)、2a mol H2(g),等效为在原平衡的基础上增大一倍压强,平衡向正反应移动,CO的转化率增大,化学平衡常数只受温度影响,与浓度无关,温度不变,平衡常数不变,
故答案为:增大;不变;
④CO(g)+2H2(g)?CH3OH(g)△H<0,
则温度越高,逆向反应进行的程度越大,甲醇的含量就越低,
压强增大,反应正向进行的程度大,则甲醇的含量高,则图象为
 ,
,
故答案为: ;
;
故答案为:<;
②100℃,平衡时CO的转化率为0.5,所以参加反应的CO的物质的量为0.5amol.
CO(g)+2H2(g)?CH3OH(g);
开始(mol):a 2a 0
变化(mol):0.5a a 0.5a
平衡(mol):0.5a a 0.5a
所以平衡时,CO的浓度为
| 0.5amol |
| bL |
| a |
| 2b |
| a |
| b |
| 0.5amol |
| bL |
| a |
| 2b |
| c(CH3OH) |
| c(CO)c2(H2) |
| a | ||||||
|
| b2 |
| a2 |
故答案为:
| b2 |
| a2 |
③在温度和容积不变的情况下,再向平衡体系中充入a mol CO(g)、2a mol H2(g),等效为在原平衡的基础上增大一倍压强,平衡向正反应移动,CO的转化率增大,化学平衡常数只受温度影响,与浓度无关,温度不变,平衡常数不变,
故答案为:增大;不变;
④CO(g)+2H2(g)?CH3OH(g)△H<0,
则温度越高,逆向反应进行的程度越大,甲醇的含量就越低,
压强增大,反应正向进行的程度大,则甲醇的含量高,则图象为
 ,
,故答案为:
 ;
;
点评:本题考查化学平衡图象、化学平衡有关计算、化学平衡常数、影响化学平衡的因素等知识点,是对知识的综合运用,应加强平时知识的积累,应注意图象的利用来分析解决问题,图象中的信息是解答本题的关键,题目难度中等.

练习册系列答案
相关题目
根据元素周期律,下列判断正确的是( )
| A、碱性 Mg(OH)2>Ca(OH)2 |
| B、酸性 H2SO4<H2CO3 |
| C、稳定性 H2S>H2Se |
| D、原子半径 S>P |
将质量分数为a%的NaOH溶液蒸发掉bg水后,变成cmL 2a%的NaOH不饱和溶液,则蒸发后所得溶液中NaOH的物质的量浓度是( )
A、
| ||
B、
| ||
C、
| ||
D、
|
双球连通管中发生2NO2?N2O4+Q(Q>0).若同时向两烧杯中分别加入等温、等体积的蒸馏水(左)和0.1mol/L H2O2溶液(右),再向右侧烧杯中加入少量Fe2(SO4)3固体后,则下列有关推断中正确的是( )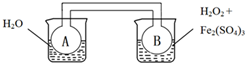

| A、实验时,A、B中的压强始终相等 |
| B、若右侧烧杯发生吸热反应,则A中更快达到平衡 |
| C、若右侧烧杯发生放热反应,则A中颜色较深 |
| D、能用该装置推断右侧烧杯中反应的热效应 |
下列叙述中正确的是( )
| A、CO2分子内含有极性键,所以CO2分子是极性分子 |
| B、气态氢化物的稳定性:NH3>PH3>AsH3 |
| C、分子晶体、原子晶体中一定含有共价键,离子晶体一定含有离子键 |
| D、某非金属元素从游离态变成化合态时,该元素一定被还原 |
 .下列化合物中,不能与2一奈酚互为同分异构体的是( )
.下列化合物中,不能与2一奈酚互为同分异构体的是( )



 下表列出了断裂某些化学键所需的能量:
下表列出了断裂某些化学键所需的能量: