题目内容
11.为研究某抗酸药的主要成份,取其中的固体粉末进行实验.水溶性试验表明,固体粉末部分溶解.经检测,不溶物为白色固体粉末甲,可溶于盐酸;可溶物为化合物乙.取该抗酸药的两种主要成分甲和乙两种化合物中仅含H、C、N、O、Ca五种元素,且甲、乙中都含有C、O两种元素.取25.0g甲经高温灼烧,只生成14.0g固体氧化物丙和5.6L(已换算成标准状态下的体积)气体氧化物丁.
经测定,乙的相对分子质量为75;常温下,乙能跟盐酸溶液反应,也能跟氢氧化钠溶液反应,两反应中反应物的物质的量之比均为1:1,都没有气泡生成现象.
(1)写出丁的电子式
 ;
;(2)实验室里可用以下流程来测量某样品中甲物质的含量

步骤⑤中发生反应的离子方程式2MnO4-+5H2C2O4+10H+=2Mn2++10CO2↑+8H2O,滴定时判断终点的现象是滴入最后一滴溶液变紫红色,振荡半分钟不褪色.
(3)写出乙的分子式C2H5NO2;写出乙物质跟盐酸反应的离子方程式H2NCH2COOH+H+→+H3NCH2COOH.
(4)用钠熔法试验乙后有固体残渣生成,取固体残渣溶于蒸馏水配成溶液,再依次加入适量的新制硫酸亚铁溶液、氯化铁溶液,可观察到蓝色沉淀.若是在隔绝空气中条件下用乙物质进行钠熔法试验时会不会有氮气生成不会生成氮气,原因是甘氨酸中氮显-3价,钠只有强还原性,试验中氮元素不可能被氧化成N2.
分析 甲物质为某抗酸药的主要成份之一,甲能与酸反应.取适量此抗酸药进行实验.水溶性实验表明,固体粉末部分溶解.不溶物为白色固体粉末甲,可溶于盐酸并产生无色无味气体,该无色无味气体.取25.0g甲经高温灼烧,只生成14.0g固体氧化物丙和5.6L(已换算成标准状态下的体积)气体氧化物丁,氧化物丁为上述无色无味气体,氧化物丁的质量为25g-14g=11g,物质的量为$\frac{5.6L}{22.4L/mol}$=0.25mol,故氧化物丁的摩尔质量=$\frac{11g}{0.25mol}$=44g/mol,故氧化物丁为二氧化碳.甲为碳酸盐,丙为金属氧化物,设金属的化合价为x,则碳酸盐为M2(CO3)x,则氧化物为M2Ox,M的相对原子质量为a,
M2(CO3)x$\frac{\underline{\;高温\;}}{\;}$M2Ox +xCO2↑
2a+60x 2a+16x 44x
25g 14g 11g
即:$\frac{2a+60x}{25}$=$\frac{2a+16x}{14}$=$\frac{44x}{11}$,解得a=40,x=2,故金属M为钙,该碳酸盐为碳酸钙;
乙的相对分子质量为75,常温下,乙能跟盐酸溶液反应,也能跟氢氧化钠溶液反应,两反应中反应物的物质的量之比均为1:1,都没有气泡生成现象,含C、O元素,则含-COOH和-NH2,由相对分子质量可知共2个C原子,分子式为C2H5NO2,结构简式为H2NCH2COOH,以此来解答.
解答 解:甲物质为某抗酸药的主要成份之一,甲能与酸反应.取适量此抗酸药进行实验.水溶性实验表明,固体粉末部分溶解.不溶物为白色固体粉末甲,可溶于盐酸并产生无色无味气体,该无色无味气体.取25.0g甲经高温灼烧,只生成14.0g固体氧化物丙和5.6L(已换算成标准状态下的体积)气体氧化物丁,氧化物丁为上述无色无味气体,氧化物丁的质量为25g-14g=11g,物质的量为$\frac{5.6L}{22.4L/mol}$=0.25mol,故氧化物丁的摩尔质量=$\frac{11g}{0.25mol}$=44g/mol,故氧化物丁为二氧化碳.甲为碳酸盐,丙为金属氧化物,设金属的化合价为x,则碳酸盐为M2(CO3)x,则氧化物为M2Ox,M的相对原子质量为a,
M2(CO3)x$\frac{\underline{\;高温\;}}{\;}$M2Ox +xCO2↑
2a+60x 2a+16x 44x
25g 14g 11g
即:$\frac{2a+60x}{25}$=$\frac{2a+16x}{14}$=$\frac{44x}{11}$,解得a=40,x=2,故金属M为钙,该碳酸盐为碳酸钙;
乙的相对分子质量为75,常温下,乙能跟盐酸溶液反应,也能跟氢氧化钠溶液反应,两反应中反应物的物质的量之比均为1:1,都没有气泡生成现象,含C、O元素,则含-COOH和-NH2,由相对分子质量可知共2个C原子,分子式为C2H5NO2,结构简式为H2NCH2COOH,
(1)由以上分析可知丁为二氧化碳,丁的电子式为 ,故答案为:
,故答案为: ;
;
(2)碳酸钙和盐酸反应生成氯化钙、二氧化碳和水,氯化钙和草酸铵反应生成草酸钙沉淀和氯化铵,反应离子方程式为Ca2++C2O42-=CaC2O4↓,草酸钙(CaC2O4)溶于稀硫酸中,然后用酸性高锰酸钾溶液进行滴定,发生的离子反应为2MnO4-+5H2C2O4+10H+=2Mn2++10CO2↑+8H2O,滴定时判断终点的现象是滴入最后一滴溶液变紫红色,振荡半分钟不褪色,
故答案为:2MnO4-+5H2C2O4+10H+=2Mn2++10CO2↑+8H2O;滴入最后一滴溶液变紫红色,振荡半分钟不褪色;
(3)由上述分析可知乙为C2H5NO2,乙物质跟盐酸反应的离子方程式为H2NCH2COOH+H+→+H3NCH2COOH,故答案为:C2H5NO2;H2NCH2COOH+H+→+H3NCH2COOH;
(4)在隔绝空气中条件下用乙物质进行钠熔法试验时不会有氮气生成,是因甘氨酸中氮显-3价,钠只有强还原性,试验中氮元素不可能被氧化成N2,
故答案为:不会生成氮气;甘氨酸中氮显-3价,钠只有强还原性,试验中氮元素不可能被氧化成N2.
点评 本题考查无机物的推断,为高频考点,把握甲、乙的推断为解答的关键,侧重分析、计算及推断能力的综合考查,涉及氧化还原反应原理、离子反应及计算等,综合性较强,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 加入适量的6mol/L的盐酸 | B. | 加入数滴氯化铜溶液 | ||
| C. | 加入适量醋酸钠溶液 | D. | 加入适量的NaOH固体 |
| A. | 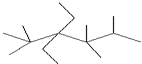 的系统命名为2,2,4,4,5-五甲基-3-二乙基己烷 的系统命名为2,2,4,4,5-五甲基-3-二乙基己烷 | |
| B. | 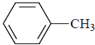 能使KMnO4溶液褪色,说明苯环与甲基相连的碳碳单键变得活泼,被KMnO4氧化而断裂 能使KMnO4溶液褪色,说明苯环与甲基相连的碳碳单键变得活泼,被KMnO4氧化而断裂 | |
| C. | 等物质的量的乙烯和乙醇的耗氧量相同 | |
| D. | 石油的分馏和煤的干馏都是物理变化 |
| A. | 按系统命名法,化合物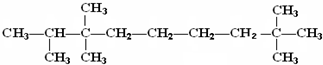 的名称为:2,3,3,8,8-五甲基壬烷 的名称为:2,3,3,8,8-五甲基壬烷 | |
| B. | 将少量溴水加入石油裂化得到的汽油中,溴水分层,上层为橙红色 | |
| C. | 往2ml10%的CuSO4溶液中加入5滴5%的NaOH溶液,再加入2ml10%的葡萄糖溶液,加热,得到砖红色的氧化亚铜沉淀 | |
| D. | 甲烷、乙醇、乙酸在一定条件下都能发生取代反应 |

| A. | 保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍 | |
| B. | 保持活塞位置不变,升高温度,达到新的平衡后,甲、乙中B的体积分数均增加 | |
| C. | 保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍 | |
| D. | 保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略) |
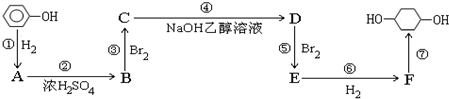
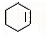 ; F
; F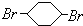 ;
;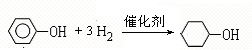 ;
;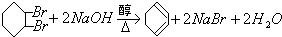 .
.

 .
.