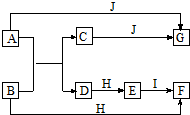
题目内容
4.下列物质既含离子键又含共价键的是( )| A. | HCl | B. | NaCl | C. | CaCl2 | D. | Na2O2 |
分析 一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,第IA、IIA族元素和第VIA、VIIA族元素之间易形成离子键.
解答 解:A.HCl分子中H原子和Cl原子之间只存在共价键,故A错误;
B.NaCl中钠离子和氯离子之间只存在离子键,故B错误;
C.氯化钙中钙离子和氯离子之间存在离子键,故C错误;
D.Na2O2中钠离子和过氧根离子之间存在离子键、O原子和O原子之间存在共价键,故D正确;
故选D.
点评 本题考查了离子键和共价键的判断,根据共价键和离子键的形成原因来分析解答,易错选项是C,注意氯化钙中两个氯离子之间不存在化学键,为易错点.

练习册系列答案
相关题目
11.下面各容器中盛有海水,铁在其中被腐蚀时由快到慢的顺序是( )
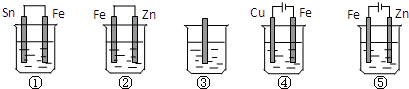

| A. | ①>②>③>④>⑤ | B. | ⑤>①>③>②>④ | C. | ⑤>①>②>③>④ | D. | ⑤>②>①>③>④ |
15.下列实验方案鉴別Na2CO3和NaHCO3,粉末能达到预期目的是( )
| A. | 分别加等体枳、等浓度的稀盐酸,比较生成气体的快慢 | |
| B. | 分别加等体积适量的水,比较固体溶解量的多少 | |
| C. | 分别将两种粉末配成溶液,然后加入澄清的石灰水,比较是否有沉淀生成 | |
| D. | 分別将两种粉末加热,并将产生的气体通入澄清的石灰水,比较澄清石灰水是否变涿浊 |
12.设NA为阿伏加德罗常数,下列说法中正确的是( )
| A. | 2.4g金属镁与足量盐酸完全反应,失电子总数为0.2NA | |
| B. | 2NA个二氧化碳分子的质量为44g | |
| C. | 0.1mol/L NaCl溶液中,Na+与Cl-离子总数为0.1NA | |
| D. | 17g氨气中所含原子数为NA |
19.下列有关除杂方法正确的是( )
| A. | 除去Fe3+中Al3+:加入过量氨水充分反应后,过滤 | |
| B. | 除去FeCl3 中少量CuCl2:用足量的铁粉,过滤 | |
| C. | 除去石英中的碳酸钙:用足量稀盐酸溶解后,过滤 | |
| D. | 除去铝粉中的镁粉:加入足量的氢氧化钠溶液后,过滤 |
9.某无色溶液中存在大量的H+、NH4+、Cl-,该溶液中还可能大量存在的离子是( )
| A. | K+ | B. | Ag+ | C. | OH- | D. | HCO3- |
13.下列说法中错误的是( )
| A. | “液氯”和“氯水”是同一物质 | |
| B. | 利用氨气极易溶解于水的性质,可以用氨气做的喷泉实验 | |
| C. | NO2溶于水发生了氧化还原反应,它既是氧化剂又是还原剂 | |
| D. | 用玻璃棒分别蘸取浓盐酸和浓氨水并互相靠近,能看到白色烟 |
14.如图是产生和收集气体的实验装置,该装置最适合于( )


| A. | 用浓盐酸和MnO2反应制取Cl2 | |
| B. | 用浓硫酸与Na2SO3反应制取SO2 | |
| C. | 用H2O2溶液和MnO2反应制取O2 | |
| D. | 用NH4Cl浓溶液和Ca(OH)2浓溶液反应制取NH3 |