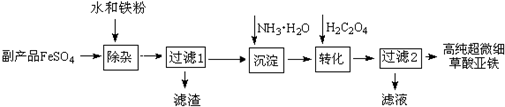
题目内容
4.足量的SO2通入下列溶液中后,是否产生沉淀?能产生沉淀的说明沉淀的成分.| 序号 | 溶液 | 是否产生沉淀 | 沉淀成分 |
| ① | Ca(OH)2 | ||
| ② | BaCl2 | ||
| ③ | BaCl2和氨水 | ||
| ④ | BaCl2和氯水 | ||
| ⑤ | H2S | ||
| ⑥ | Ba(NO3) |
分析 二氧化硫为酸性氧化物能够与碱反应生成亚硫酸盐,二氧化硫过量生成亚硫酸氢盐;二氧化硫与水反应生成亚硫酸,酸性弱于盐酸;二氧化硫具有氧化性,能够与硫化氢反应生成硫单质;二氧化硫具有还原性,能够与氧化性物质反应生成硫酸根离子,据此解答.
解答 解:①足量二氧化硫与氢氧化钙反应生成亚硫酸氢钙溶液,不会产生沉淀;
②亚硫酸酸性弱于盐酸,二氧化硫与氯化钡不反应,不会产生沉淀;
③二氧化硫通入BaCl2和氨水反应生成亚硫酸氢钡溶液和氯化铵,不会产生沉淀;
④二氧化硫通入BaCl2和氯水,二氧化硫被氯气氧化生成硫酸根离子,硫酸根离子与钡离子反应生成硫酸钡沉淀;
⑤二氧化硫与硫化氢反应生成单质硫,硫不溶液水,为沉淀;
⑥二氧化硫通入硝酸钡,二氧化硫被氧化生成硫酸根离子,硫酸根离子与钡离子反应生成硫酸钡沉淀;
故答案为:①否;
②否;
③否;
④是;BaSO4;
⑤是;S;
⑥是;BaSO4;
点评 本题考查了二氧化硫的性质,熟悉二氧化硫酸性氧化物、还原性、氧化性是解题关键,题目难度不大.

练习册系列答案
相关题目
12.某醇A通过一系列反应可得到丙三醇,还可以通过氧化反应、酯化反应、加聚反应最后得到高分子化合物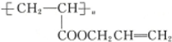 ,则醇A的结构简式为 ( )
,则醇A的结构简式为 ( )
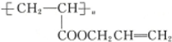 ,则醇A的结构简式为 ( )
,则醇A的结构简式为 ( )| A. | CH3CH2CH2OH | B. | CH2═CHCH2OH | C. | 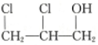 | D. | 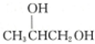 |
19.下列解释实验事实的化学方程式正确的是( )
| A. | FeCl3溶液中通入SO2,溶液黄色褪去:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ | |
| B. | 90℃时,测得纯水中c(H+)•c(OH-)=3.8×10-13:H2O(l)?H+(aq)+OH-(aq)△H<0 | |
| C. | 氨水中滴入酚酞溶液,溶液变红:NH3•H2O=NH4++OH- | |
| D. | 向苯酚钠溶液中通入CO2,溶液变浑浊:2C6H5ONa+CO2+H2O→2C6H5OH+Na2CO3 |
13.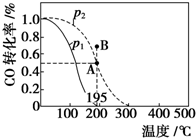 在20L的密闭容器中按物质的量之比为1:2充入CO和H2,发生:CO(g)+2H2(g)?CH3OH(g)△H.测得CO的转化率随温度及不同压强下的变化如图所示,p2和195℃时n(H2)随时间的变化结果如表所示.下列说法正确的是( )
在20L的密闭容器中按物质的量之比为1:2充入CO和H2,发生:CO(g)+2H2(g)?CH3OH(g)△H.测得CO的转化率随温度及不同压强下的变化如图所示,p2和195℃时n(H2)随时间的变化结果如表所示.下列说法正确的是( )
p2及195℃n(H2)随时间变化
 在20L的密闭容器中按物质的量之比为1:2充入CO和H2,发生:CO(g)+2H2(g)?CH3OH(g)△H.测得CO的转化率随温度及不同压强下的变化如图所示,p2和195℃时n(H2)随时间的变化结果如表所示.下列说法正确的是( )
在20L的密闭容器中按物质的量之比为1:2充入CO和H2,发生:CO(g)+2H2(g)?CH3OH(g)△H.测得CO的转化率随温度及不同压强下的变化如图所示,p2和195℃时n(H2)随时间的变化结果如表所示.下列说法正确的是( ) p2及195℃n(H2)随时间变化
| t/min | 0 | 1 | 3 | 5 |
| n(H2)/mol | 8 | 5 | 4 | 4 |
| A. | p1>p2,△H<0 | |
| B. | 在p2及195℃时,反应前3 min的平均速率v(CH3OH)=0.8 mol•L-1•min-1 | |
| C. | 在p2及195℃时,该反应的平衡常数为25 | |
| D. | 在B点时,v正>v逆 |
14.升高温度能使反应速率加快,下列叙述正确的是( )
| A. | 降低反应所需的活化能 | |
| B. | 使反应体系的活化分子百分数增大 | |
| C. | 体系中活化分子总数不变 | |
| D. | 对于吸热反应、放热反应,反应速率同等程度加大 |