题目内容
18.下列反应过程中,同时有非极性共价键断裂和形成的是( )| A. | 2H2+O2═H2O | B. | NH3+HCl═NH4Cl | ||
| C. | 4Fe(OH)2+2H2O+O2═4Fe(OH)3 | D. | 2Na2O2+2H2O═4NaOH+O2↑ |
分析 化学反应的实质为旧键断裂、新键形成,一般来说,活泼金属与非金属形成离子键,同种非金属元素之间形成非极性共价键,不同非金属元素之间形成极性共价键,以此来解答.
解答 解:A、氢气和氧气断裂非极键,而水形成极性共价键,故A错误;
B、NH3+HCl═NH4Cl反应中断裂极性O2共价键,形成离子键,没有非极性共价键断裂和形成,故B错误;
C、Fe(OH)2中含有离子键和极性共价键,O2中含有非极性共价键,则反应物中有离子键、极性共价键断裂,没有非极性键的断裂,故C错误;
D、2Na2O2+2H2O═4NaOH+O2↑,过氧化钠中含有氧氧非极性键,氧气中有氧氧非极性键,所以同时有非极性共价键断裂和形成,故D正确;
故选D.
点评 本题考查化学反应及化学键,为高频考点,把握化学键判断的一般规律分析化学键的断裂和形成为解答的关键,注重分析能力和基础知识的考查,题目难度不大.

练习册系列答案
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案
相关题目
8.某溶液中含有0.2mol•L-1 NH4+、0.25mol•L-1 Fe2+、0.4mol•L-1 Cl-及一定量的SO4 2-,则SO42-的物质的量浓度为( )
| A. | 0.1 mol•L-1 | B. | 0.3 mol•L-1 | C. | 0.5 mol•L-1 | D. | 0.15 mol•L-1 |
6.桶烯结构简式如图所示,有关说法不正确的是( )
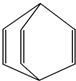

| A. | 桶烯能在NaOH水溶液中发生加成反应 | |
| B. | 桶烯中的一个氢原子被氯原子取代,所得产物有2种 | |
| C. | 桶烯与苯乙烯(C6H5CH═CH2)互为同分异构体 | |
| D. | 桶烯在一定条件下能发生缩聚反应形成高分子化合物 |
13.下列物质中分子间能形成氢键的是( )
| A. | N2 | B. | HBr | C. | H2S | D. | NH3 |
3.某元素二价阳离子核外有18个电子,质量数为42,该元素原子的原子核中的中子数为( )
| A. | 18 | B. | 20 | C. | 16 | D. | 22 |
 与适量NaHCO3溶液反应制备
与适量NaHCO3溶液反应制备
 与NaOH的醇溶液共热制备CH3-CH=CH2.
与NaOH的醇溶液共热制备CH3-CH=CH2.