��Ŀ����
1��̼��������FeCO3������þ�����Ҫ�ɷ֣���FeCO3���ȵ�200�濪ʼ�ֽ�ΪFeO��CO2�����ڿ����и�������FeCO3����Fe2O3��I����֪25�棬101kPaʱ��
4Fe��s��+3O2��g��=2Fe2O3��s����H=-1648kJ/mol
C��s��+O2��g��=CO2��g����H=-393kJ/mol
2FeCO3��s��=2Fe��s��+2C��s��+3O2��g����H=+1480kJ/mol
��1����д��FeCO3�ڿ�������������Fe2O3���Ȼ�ѧ����ʽ4FeCO3��s��+O2��g��=2Fe2O3��s��+4CO2��g����H=-260kJ/mol��
II�����ɵ�FeO��Fe2O3��һ�������±���ԭΪ��������
��2���ݱ���һ��������Fe2O3�ɱ����黹ԭΪ���������Ľ��������䷴ӦΪ��Fe2O3��s��+3CH4��g��=2Fe��s��+3CO��g��+6H2��g����H��0
��ԭ������Ϊ26����Ԫ��λ��Ԫ�����ڱ��ĵ������ڣ�
�ڷ�Ӧ��5L���ܱ������н��У�2min��ﵽƽ�⣬���Fe2O3�ڷ�Ӧ����������4.8g����ö�ʱ������H2�����ƽ����Ӧ����Ϊ0.018mol/��L•min����
�۽�һ������Fe2O3��s����һ������CH4��g�����ں��º�ѹ�����У���һ�������·�Ӧ���ܱ����÷�Ӧ�ﵽƽ��״̬����b��c��d��
a��CH4��ת���ʵ���CO�IJ���
b����������ƽ����Է�����������
c��v����CO����v����H2��=1��2
d�����������������
��3��FeO����CO���л�ԭ����֪��t��ʱ��FeO��s��+CO��g��?Fe��s��+CO2��g����K=0.5������1L�ܱ������м���0.04molFeO��s������ͨ��xmolCO��t��ʱ��Ӧ�ﵽƽ�⣮��ʱFeO��s����ת����Ϊ50%����x=0.06��
III��Fe2O3���������Ʊ�FeCl3��FeCl3��ˮ��Һ�е�ˮ���������
Fe3++H2O?Fe��OH��2++H+ K1
Fe��OH��2++H2O?Fe��OH��2+H+K2
Fe��OH��2++H2O?Fe ��OH��3+H+ K3
��4������ˮ�ⷴӦ��ƽ�ⳣЧK1��K2��K3�ɴ�С��˳����K1��K2��K3��ͨ����������������ˮ�����ۺ����ɾۺ�������ӷ���ʽΪ��xFe3++yH2O=Fex��OH��y��3x-y��++yH+
��ʹƽ�������ƶ��ɲ��õķ�����a��c��d������ĸ��
a����ˮϡ�� b����������NaCl���� c������ d����������Na2CO3���壮
���� I����1��FeCO3�ڿ�������������Fe2O3�Ļ�ѧ����ʽΪ��4FeCO3��s��+O2��g��=2Fe2O3��s��+4CO2��g�����÷�Ӧ������֪��ЧӦ�Ļ�ѧ����ʽ�Ƶ������ݸ�˹���ɼ���÷�Ӧ���ʱ䣻
II����2����Feλ�����ڱ��е������ڣ�VIII�壻
�ڸ���2min��Fe2O3����4.8g�������ʱ�����H2��Ӧ�����ʵ��������ݻ�ѧ��Ӧƽ�����ʹ�ʽ$\overline{r}��{H}_{2}��=\frac{��n}{V��t}$������H2�����ƽ����Ӧ���ʣ�
��װ��Ϊ���º�ѹ��������Ӧ���������У���ϵѹǿʼ�ձ��ֲ��䣬��ϳ����жϻ�ѧ��Ӧ�ﵽƽ����ж����ݣ����¶ȣ����ʣ��ܶȣ�ƽ����Է����������ݴ˷�����
��3������t��ʱ�Ļ�ѧƽ�ⳣ������ƽ��ʱ����ֵ����ʵ���Ũ�ȣ��ݴ˼���x��ֵ��
III����4���ֲ�ˮ�ⷴӦ�����ܵ����Ƶģ���һ�����ڶ���������������ϵ���øı仯ѧƽ��ķ��������������ӷ�Ӧ��Ũ�ȣ�����������ı��¶Ⱥ�ѹǿ���ݴ˷�����
��� �⣺I����1����֪����4Fe��s��+3O2��g��=2Fe2O3��s����H1=-1648kJ/mol��
��C��s��+O2��g��=CO2��g����H2=-393kJ/mol��
��2FeCO3��s��=2Fe��s��+2C��s��+3O2��g����H3=+1480kJ/mol��
FeCO3�ڿ�������������Fe2O3�Ļ�ѧ����ʽΪ��4FeCO3��s��+O2��g��=2Fe2O3��s��+4CO2��g�����÷�Ӧ���ɢۡ�2+��+�ڡ�4�õ������ݸ�˹���ɣ��÷�Ӧ���ʱ��H=2��H3+��H1+4��H2=-260kJ/mol��
�ʴ�Ϊ��4FeCO3��s��+O2��g��=2Fe2O3��s��+4CO2��g����H=-260kJ/mol��
II����2����Feλ�����ڱ��е������ڣ�VIII�壬
�ʴ�Ϊ���ģ�
�ڸ���2min��Fe2O3����4.8g����$\frac{4.8g}{160g/mol}$=0.03mol�����ݷ�Ӧ����ʽ������H2�����ʵ���Ϊ0.03mol��6=0.18mol�����Ϊ5L����Ӧ����ʱ��Ϊ��t=2min����ö�ʱ������H2�����ƽ����Ӧ����Ϊ$\overline{r}��{H}_{2}��$=$\frac{��n��{H}_{2}��}{V��t}$=$\frac{0.18mol}{5L��2min}$=0.018mol/��L•min����
�ʴ�Ϊ��0.018mol/��L•min����
��װ��Ϊ���º�ѹ��������Ӧ���������У���ϵѹǿʼ�ձ��ֲ��䣬��ϳ����жϻ�ѧ��Ӧ�ﵽƽ����ж����ݣ����¶ȣ����ʣ��ܶȣ�ƽ����Է�������������
a��CH4��ת���ʺ�CO�IJ���Ӧ���ݾ���ķ�Ӧ�����ʵ���ȷ��������һ����ѧ��Ӧ�ﵽƽ��״̬����CH4��ת���ʵ���CO�IJ��ʣ���a��ѡ��
b����������ƽ����Է�������Ϊ$\overline{{M}_{r}}$=$\frac{{m}_{��}}{{n}_{��}}$����Ӧ����������μӵķ�Ӧ����Ӧǰ��������������������ı䣬���������Ҳ�����ı䣬��������ƽ����Է��������������ı䣬�����жϻ�ѧ��Ӧ�Ƿ�ﵽƽ�⣬��bѡ��
c�������ʵĻ�ѧ��Ӧ���ʱ��ﻯѧƽ�⣬��ע������Ӧ�����淴Ӧ���ʣ���v����CO����v����H2��=1��2�����жϻ�ѧ��Ӧ�Ƿ�ﵽƽ�⣬��cѡ��
d����Ӧ����μӣ��������������ı䣬�������������ı�ʱ�������жϻ�ѧ��Ӧ�Ƿ�ﵽƽ�⣬��dѡ��
�ʴ�Ϊ��b��c��d��
��3��t��ʱ��������ӦFeO��s��+CO��g��?Fe��s��+CO2��g������Ӧ��ƽ�ⳣ��ΪK=$\frac{c��C{O}_{2}��}{c��CO��}$=0.5����1L�ܱ������м���0.04molFeO��s������ͨ��xmolCO��Ӧ�ﵽƽ�⣬FeO��ת����Ϊ50%����ƽ��ʱc��CO��=$\frac{x-0.04��50%}{1}$=��x-0.02��mol/L��c��CO2��=$\frac{0.04��50%}{1}$=0.02mol/L������K=$\frac{c��C{O}_{2}��}{c��CO��}$=$\frac{0.02}{x-0.02}$=0.5���ɵ�x=0.06��
�ʴ�Ϊ��0.06��
III����4���ֲ�ˮ�ⷴӦ�����ܵ����Ƶģ���һ�����ڶ���������������ˮ�ⷴӦ��ƽ�ⳣЧK1��K2��K3�ɴ�С��˳���ǣ�K1��K2��K3��
��ϵ���øı仯ѧƽ��ķ��������������ӷ�Ӧ��Ũ�ȣ�����������ı��¶Ⱥ�ѹǿ������
a����ˮϡ�ͣ������ڴٽ�ˮ��ƽ�������ƶ�����aѡ��
b����������NaCl���壬���μӷ�Ӧ����ƽ�⼸��û��Ӱ�죬��b��ѡ��
c��ˮ�ⷴӦ�����ȷ�Ӧ������������ˮ�ⷴӦ�����ƶ�����cѡ��
d����������Na2CO3���壬������Һ�е�H+����Ӧ��Ũ�Ƚ��ͣ��ٽ���ѧƽ�������ƶ�����dѡ��
�ʴ�Ϊ��K1��K2��K3��a��c��d��
���� ���⿼�黯ѧԭ������֪ʶ�������Ȼ�ѧ����ʽ����д����˹���ɵ�Ӧ�ã���ѧ��Ӧ���ʵļ��㣬��ѧƽ����ƶ�����ѧƽ�ⳣ���йصļ��㣬����ˮ���֪ʶ���漰��֪ʶ��϶࣬��Ϊ��Ƶ���㣬��Ҫ���գ���Ŀ�Ѷ��еȣ�

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�| A�� | ��������ˮ | B�� | ��ʳ�׳�ȥˮ�� | ||
| C�� | ��ʯ��ʹ������ɶ��� | D�� | �ú�NaHCO3��ҩ������θ����� |
| A�� | ����һ����ɫ���壬������̬�⻯��ܲ��ȶ� | |
| B�� | �廯����Ȼ����ȶ���HClO4����ǿ��HBrO4 | |
| C�� | 卑����������ܽ���ˮ������������һ����ǿ�� | |
| D�� | F2��ˮ��Ӧ��Cl2��ˮ��Ӧ���� |
| A�� | ���ٶԻ�������Ⱦ | |
| B�� | �о��任����ԭ�Ϻ���ʼ������ | |
| C�� | ��ƶ����ཡ���ͻ�������ȫ�Ļ����� | |
| D�� | ������δȻ�����նž���ѧ��ȾԴ |
| A�� | CH2=CH-CH=CH2 1��3-����ϩ | B�� |  3-���� 3-���� | ||
| C�� |  ������ ������ | D�� |  2-�һ����� 2-�һ����� |
����ϩͨ��ˮ�м���ת��Ϊ�Ҵ�
����ϩ�����㽶��ˮ���Ĵ����
����ϩ��������ˮ������Ӧ��1mol��ϩ�ӳ�����1mol�嵥�ʣ�˵����ϩ���Ӻ���һ��̼̼˫��
����ϩ�ܹ�������KMnO4��Һ��������˵����ϩ�ṹ�к���һ��̼̼˫��
����ϩ����������ԭ����ͬһ��ƽ�森
| A�� | �٢ڢ� | B�� | �ڢܢ� | C�� | �ڢۢ� | D�� | �٢ܢ� |
| A�� | С�մ���Һ����������ʯ��ˮ��ϣ�Ca2++OH-+HCO3-�TCaCO3��+H2O | |
| B�� | AlCl3��Һ�м��������İ�ˮ��Al3++4OH-�TAlO2-+2H2O | |
| C�� | ̼�������Һ��������NaOH��Һ���ȣ�NH4++OH-?NH3��+H2O | |
| D�� | ��Fe��NO3��2��Һ�м���ϡ���3Fe2++4H++NO3-�T3Fe3++NO��+2H2O |
 ��
�� ��
�� ���������ŵ�������̼̼˫����ȩ�������л�����Ӿ۷�Ӧ�����ò���Ľṹ��ʽΪ
���������ŵ�������̼̼˫����ȩ�������л�����Ӿ۷�Ӧ�����ò���Ľṹ��ʽΪ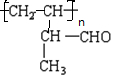 ��
��