题目内容
11.按要求填空(1)羟基的电子式是
 ;
;(2)(CH3CH2)2C(CH3)2的名称为3,3-二甲基戊烷;
(3)2-甲基-1-丁烯的键线式
 ;
;(4)相对分子质量最小的有机物分子式CH4,糖尿病患者尿液中含的糖类结构简 式CH2OH(CHOH)4CHO;
(5)
 所含官能团的名称是碳碳双键,醛基;该有机物发生加聚反应后,所得产物的结构简式为
所含官能团的名称是碳碳双键,醛基;该有机物发生加聚反应后,所得产物的结构简式为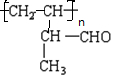 ;
;(6)3-甲基戊烷的一氯代产物有4种(不考虑立体异构).
分析 (1).羟基为中性氧原子,氧原子最外层为7个电子;
(2)(CH3CH2)2C(CH3)2为烷烃,选取最长碳链为主碳链,离取代基近的一端编号写出名称;
(3)根据键线式和碳原子的成键情况可以写出键线式;
(4)相对分子质量最小的有机物是甲烷;糖尿病患者尿液中含的糖是葡萄糖;
(5) 官能团为碳碳双键和醛基,加聚反应是发生碳碳双键的加成反应生成高分子化合物;
官能团为碳碳双键和醛基,加聚反应是发生碳碳双键的加成反应生成高分子化合物;
(6)根据等效H原子判断,有几种H原子,一氯代产物有几种同分异构体.
分子中等效氢原子一般有如下情况:
①分子中同一甲基上连接的氢原子等效,同一碳原子所连的氢原子是等效的;
②同一碳原子所连甲基上的氢原子等效;
③处于镜面对称位置(相当于平面成像时,物与像的关系)上的氢原子等效.
解答 解:(1)羟基中氧原子最外层为7个电子,氢原子最外层2个电子,羟基的电子式为: ,故答案为:
,故答案为: ;
;
(2)(CH3CH2)2C(CH3)2的最长碳链为5个,离取代基近的一端编号,3号碳有两个甲基,名称为3,3-二甲基戊烷,故答案为:3,3-二甲基戊烷;
(3)2-甲基-1-丁烯的键线式为
故答案为:
(4)甲烷是相对分子质量最小的有机物,分子式为:CH4,糖尿病患者尿液中含的糖是葡萄糖,它的结构简式为:CH2OH(CHOH)4CHO,
故答案为:CH4;CH2OH(CHOH)4CHO;
(5) 分子结构中含碳碳双键和醛基官能团,该有机物发生加聚反应是发生碳碳双键的加成反应生成高分子化合物,结构简式为:
分子结构中含碳碳双键和醛基官能团,该有机物发生加聚反应是发生碳碳双键的加成反应生成高分子化合物,结构简式为: ,
,
故答案为:碳碳双键和醛基; ;
;
(6)3-甲基戊烷的碳链结构为 ,1、5号碳原子,2、4号碳原子对称,分别处于1(或5)、2(或4)、3、6号碳原子上H原子不同,所以分子中有4种H原子,故3-甲基戊烷的一氯代产物有4种,
,1、5号碳原子,2、4号碳原子对称,分别处于1(或5)、2(或4)、3、6号碳原子上H原子不同,所以分子中有4种H原子,故3-甲基戊烷的一氯代产物有4种,
故答案为:4.
点评 本题考查了有机物电子式、命名方法、加聚反应产物分析、同分异构体书写等,掌握基础是解题关键,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 10种 | B. | 13种 | C. | 16种 | D. | 22种 |
| A. | O2和O3互为同位素 | B. | O2和O3的相互转化是物理变化 | ||
| C. | 等质量的O2和O3含有的原子数相同 | D. | 等体积的O2和O3含有的分子数相同 |
Ⅰ、工业上一种制备H2S的方法是在催化剂、高温条件下,用天然气与SO2反应,同时生成两种能参与大气循环的氧化物.
(1)该反应的化学方程式为4SO2+3CH4═4H2S+3CO2+2H2O.
II.H2S可用于检测和沉淀金属阳离子.
(2)H2S的第一步电离方程式为H2S?H++HS-.
(3)己知:25℃时,Ksp(SnS)=1.0×10-25,Ksp(CdS)=8.0×10-27,该温度下,向浓度均为0.1mol•L-1的CdCl2和SnCl2的混合溶液中通人H2S,当Sn2+开始沉淀时,溶液中c(Cd2+)=8.0×10-3mol/L(溶液体积变化忽略不计).
Ⅲ.H2S是煤化工原料气脱硫过程的重要中间体.反应原理为:
ⅰ.COS(g)+H2(g)?H2S(g)+CO(g)△H=+7kJ•mol-1;
ⅱ.CO(g)+H2O(g)?CO2(g)+H2(g)△H=-42kJ•mol-1;
(4)己知:断裂1mol分子中的化学键所需吸收的能量如下表所示.
| 分子 | COS(g) | H2(g) | CO(g) | H2S(g) | H2O(g) | CO2(g) |
| 能量/kJ•mol-1 | 1319 | 442 | x | 678 | -930 | 1606 |
(5)向10L容积不变的密闭容器中充入1mol COS(g)、1mol H2(g)和1mol H2O(g),进行上述两个反应.其他条件不变时,体系内CO的平衡体积分数与温度(T)的关系如图所示.

①随着温度升高,CO的平衡体积分数增大(填“增大”或“减小”),原因为反应I为吸热反应,升高温度,平衡正向移动,CO的平衡体积分数增大;反应II为放热反应,升高温度,平衡逆向移动,CO的平衡体积分数也增大.
②T1℃时,测得平衡时体系中COS的物质的童为0.80mol.则该温度下,COS的平衡转化率为20%;反应i的平衡常数为0.044(保留两位有效数字).


