题目内容
6.已知:醇的命名中羟基必须连在主链碳上.对于化学式为C5H12O2的二元醇,其主链为4个碳原子且羟基不连在同一个碳原子上的同分异构体有(不含立体异构)( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
分析 先确定主链碳原子然后确定支链,书写烷烃的同分异构体的方法:①成直链、一线串;②从头摘、挂中间;③往边排、不到端.
解答 解:主链上有4个碳原子时,其碳链为 (1、2、3、4为碳原子编号),其中两个-OH所连碳原子的编号可能为:1-2、1-3、1-4、2-3、2-4、3-4共6种,即主链为4个碳原子且羟基不连在同一个碳原子上的同分异构体有6种;
(1、2、3、4为碳原子编号),其中两个-OH所连碳原子的编号可能为:1-2、1-3、1-4、2-3、2-4、3-4共6种,即主链为4个碳原子且羟基不连在同一个碳原子上的同分异构体有6种;
故选D.
点评 本题考查同分异构体的书写,注意先写碳链异构,再写位置异构,难度不大,侧重于考查学生的分析能力和应用能力.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
9.下列反应中,反应条件、加液顺序、反应物用量或浓度等改变时,反应产物均不发生变化的是( )
| A. | 钠与氧气反应 | B. | 盐酸和碳酸氢钠溶液 | ||
| C. | 铜与硝酸反应 | D. | 氯化铝溶液和氢氧化钠溶液反应 |
17.下列叙述正确的是( )
| A. | 6.02×1023叫做阿伏加德罗常数 | |
| B. | 摩尔(mol)是国际单位制中七个基本单位之一 | |
| C. | 1mol气体的体积随压强和温度的增大而变小 | |
| D. | 气体摩尔体积(Vm)是指1 mol任何气体所占的体积都约为22.4 L |
14.分子式为C8H8O2的有机物,结构中含有苯环且能够发生水解反应的同分异构体(不考虑立体结构)有( )
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
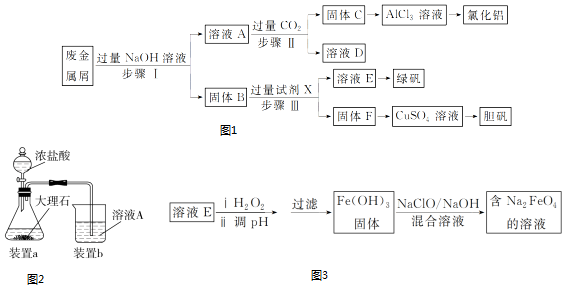
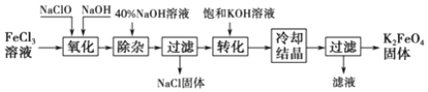
1.从某废液(含有Fe2+、Cu2+、Cl-)中回收铜并制得纯净的FeCl3溶液.现以制得纯净的FeCl3溶液为原料制取优良的水处理剂高铁酸钾(K2FeO4),其流程如图:
已知:高锰酸钾(K2FeO4)位暗紫色固体,可溶于水.在中性或酸性溶液中逐渐分解,在碱性溶液中稳定.高锰酸钾具有强氧化性.高锰酸钾(K2FeO4)与水作用产生Fe(OH)3.
(1)检验废液中含有Fe2+选用的试剂是KMnO4(填化学式);从废液中制得纯净的FeCl3溶液加入的试剂除铁粉外,还需要一种试剂是Cl2(填化学式),加入时发生反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-.
(2)高锰酸钾(K2FeO4)在处理水过程中的作用是杀菌消毒和净水.
(3)“氧化”过程反应的离子方程式为2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O.
(4)过滤时需用的玻璃仪器有玻璃棒、烧杯和漏斗,上述工艺得到的高锰酸钾常含有杂志,可用重结晶法提纯,操作是:将粗产品用饱和KOH溶液溶解,然后加热浓缩、冷却结晶、过滤.
(5)用回收的铜为原料可制得粗制CuSO4•5H2O晶体(含有少量的FeSO4•7H2O),除去CuSO4•5H2O晶体中杂志的方法是:向溶液中加入H2O2,再调解溶液PH,过滤即可制得纯净的CuSO4溶液,进而制得纯净CuSO4•5H2O的晶体.
已知:室温时一些物质的Kaq如表:
已知溶液中的离子浓度小于1×10-6mol•L-1时就认定沉淀完全.
加双氧水的目的是将亚铁离子氧化成铁离子;若溶液中CuSO4的浓度为3.0mol•L-1,通过计算说明此方法可除去粗制CuSO4•5H2O晶体中FeSO4•7H2O的理由通常认为溶液中的离子浓度小于1×10-6mol•L-1时就认定沉淀完全,设溶液中CuSO4的浓度为3.0mol•L-1,则Cu(OH)2开始沉淀时的PH为4,Fe3+完全沉淀时溶液的PH为3.3,通过计算确定上述方案可行.

已知:高锰酸钾(K2FeO4)位暗紫色固体,可溶于水.在中性或酸性溶液中逐渐分解,在碱性溶液中稳定.高锰酸钾具有强氧化性.高锰酸钾(K2FeO4)与水作用产生Fe(OH)3.
(1)检验废液中含有Fe2+选用的试剂是KMnO4(填化学式);从废液中制得纯净的FeCl3溶液加入的试剂除铁粉外,还需要一种试剂是Cl2(填化学式),加入时发生反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-.
(2)高锰酸钾(K2FeO4)在处理水过程中的作用是杀菌消毒和净水.
(3)“氧化”过程反应的离子方程式为2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O.
(4)过滤时需用的玻璃仪器有玻璃棒、烧杯和漏斗,上述工艺得到的高锰酸钾常含有杂志,可用重结晶法提纯,操作是:将粗产品用饱和KOH溶液溶解,然后加热浓缩、冷却结晶、过滤.
(5)用回收的铜为原料可制得粗制CuSO4•5H2O晶体(含有少量的FeSO4•7H2O),除去CuSO4•5H2O晶体中杂志的方法是:向溶液中加入H2O2,再调解溶液PH,过滤即可制得纯净的CuSO4溶液,进而制得纯净CuSO4•5H2O的晶体.
已知:室温时一些物质的Kaq如表:
| 化学式 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| Kaq | 8.0×10-16 | 8.0×10-18 | 8.0×10-20 |
加双氧水的目的是将亚铁离子氧化成铁离子;若溶液中CuSO4的浓度为3.0mol•L-1,通过计算说明此方法可除去粗制CuSO4•5H2O晶体中FeSO4•7H2O的理由通常认为溶液中的离子浓度小于1×10-6mol•L-1时就认定沉淀完全,设溶液中CuSO4的浓度为3.0mol•L-1,则Cu(OH)2开始沉淀时的PH为4,Fe3+完全沉淀时溶液的PH为3.3,通过计算确定上述方案可行.
15.下列各组两种物质在溶液中的反应,可用同一离子方程式表示的是( )
| A. | Cu(OH)2 和盐酸; Cu(OH)2 和 CH3COOH | |
| B. | BaCl2 和 Na2SO4; Ba(OH)2 和 CuSO4 | |
| C. | NaHCO3 和 NaHSO4; Na2CO3 和 NaHSO4 | |
| D. | NaHCO3(过量) 和 Ca(OH)2; Ca(HCO3)2 和 NaOH(过量) |
16.下列说法正确的是( )
| A. | 能电离出H+的化合物叫做酸 | |
| B. | 摩尔是七个基本物理量之一 | |
| C. | 化合物分为酸、碱、盐和氧化物是用树状分类法分类的 | |
| D. | 实验测得1mol某气体体积为22.4L,测定条件一定是标准状况 |