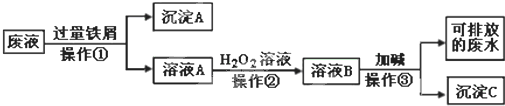
题目内容
已知下列热化学方程式:
(1)CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H1=-870.3kJ?mol-1
(2)C(s)+O2(g)═CO2(g)△H2=-393.5kJ?mol-1
(3)2H2(g)+O2(g)═2H2O(l)△H3=-571.6kJ?mol-1,
则反应2C(s)+2H2(g)+O2(g)═CH3COOH(l)的焓变△H为( )
(1)CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H1=-870.3kJ?mol-1
(2)C(s)+O2(g)═CO2(g)△H2=-393.5kJ?mol-1
(3)2H2(g)+O2(g)═2H2O(l)△H3=-571.6kJ?mol-1,
则反应2C(s)+2H2(g)+O2(g)═CH3COOH(l)的焓变△H为( )
| A、-488.3 kJ?mol-1 |
| B、-244.15 kJ?mol-1 |
| C、+488.3 kJ?mol-1 |
| D、+244.15 kJ?mol-1 |
考点:有关反应热的计算,用盖斯定律进行有关反应热的计算
专题:化学反应中的能量变化
分析:运用盖斯定律,用已知化学反应通过相互加减得到待求反应,相应的△H也同时相互加减即可.
解答:
解:(1)CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H1=-870.3kJ?mol-1
(2)C(s)+O2(g)═CO2(g)△H2=-393.5kJ?mol-1
(3)2H2(g)+O2(g)═2H2O(l)△H3=-571.6kJ?mol-1,
依据盖斯定律(2)×2+(3)-(1)得到2C(s)+2H2(g)+O2(g)═CH3COOH(l)△H=-488.3 kJ/mol
故选A.
(2)C(s)+O2(g)═CO2(g)△H2=-393.5kJ?mol-1
(3)2H2(g)+O2(g)═2H2O(l)△H3=-571.6kJ?mol-1,
依据盖斯定律(2)×2+(3)-(1)得到2C(s)+2H2(g)+O2(g)═CH3COOH(l)△H=-488.3 kJ/mol
故选A.
点评:本题考查热化学方程式的书写和盖斯定律的计算应用,题目较简单.

练习册系列答案
相关题目
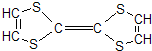 用于制造隐形飞机的某种物质具有吸收微波的功能,其主要成分的结构如图所示.关于其性质的描述不正确的是( )
用于制造隐形飞机的某种物质具有吸收微波的功能,其主要成分的结构如图所示.关于其性质的描述不正确的是( )| A、能使溴水和酸性KMnO4溶液褪色 |
| B、1mol该物质可与3molH2完全加成 |
| C、该物质在空气燃烧产生刺激性气体 |
| D、该物质属于烯烃 |
下列离子方程式正确的是( )
| A、钠和冷水反应:Na+2H2O=Na++2OH-+H2↑ | ||
| B、AlCl3溶液中加入过量的浓氨水:Al3++3NH3?H2O=Al(OH)3↓+3NH4+ | ||
C、用小苏打治疗胃酸过多:CO
| ||
| D、用FeCl3溶液腐蚀印刷电路板:Fe3++Cu=Fe2++Cu2+ |
实验室里需用950mL 0.1mol/L的硫酸铜溶液时,下列操作正确的是( )
| A、称取15.2g硫酸铜固体,加入950mL水 |
| B、称取25 g胆矾溶于水配成1000 mL溶液 |
| C、称取16 g硫酸铜固体,加入1000 mL水 |
| D、称取23.8g胆矾溶于水950mL水 |
钢铁在中性条件下发生电化学腐蚀时,正极的电极反应式为( )
| A、2H2O+O2+4e-=4OH- |
| B、2H++2e-=H2↑ |
| C、Fe-2e-=Fe2+v |
| D、Fe-3e-=Fe3+ |
硅橡胶的主要成分如图所示,是由二氯二甲基硅烷经两种反应制成的,这两种反应是( )


| A、加聚 | B、水解 | C、缩聚 | D、氧化 |
某主族元素的离子X2+外围电子层排布为6s2,当把X的最高价氧化物溶于浓盐酸时,有黄绿色气体产生,则下列说法不正确的是( )
| A、X2+具有还原性 |
| B、X的最高价氧化物具有强氧化性 |
| C、该元素是第ⅥA族元素 |
| D、X的+2价化合物比+4价化合物稳定 |