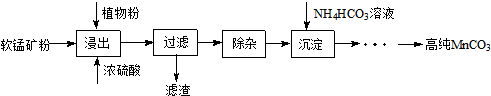
题目内容
13.设NA为阿伏加德罗常数的值,下列叙述中正确的是( )| A. | 1mol丙烷分子中,含有的非极性共价键数目为NA | |
| B. | 标准状况下,1.8gH2O分子中所含有的电子数为NA | |
| C. | 25℃时,pH=13的 Ba(OH)2溶液中含有的OH-数目为0.1 NA | |
| D. | 2.24L 氯气与过量的氢氧化钠溶液完全反应转移的电子数为0.1NA |
分析 A.丙烷中含有的非极性键为碳碳键;
B.依据n=$\frac{m}{M}$计算物质的量,结合分子式计算电子数;
C.溶液体积未知;
D.气体状况未知.
解答 解:A.丙烷中含有的非极性键为碳碳键,1个丙烷分子含有2个碳碳单键,所以1mol丙烷含有的非极性共价键数目为2NA,故A错误;
B.1.8 g H2O物质的量为:$\frac{1.8g}{18g/mol}$=0.1mol,所以含有的电子数为NA,故B正确;
C.溶液体积未知,无法计算溶液中氢氧根离子数目,故C错误;
D.气体状况未知,无法确定氯气的物质的量,故D错误;
故选:B.
点评 本题考查阿伏伽德罗常数的应用,熟悉丙烷、水分子的结构,明确以物质的量为核心的计算公式是解题关键,注意气体摩尔体积使用条件和对象,题目难度不大.

练习册系列答案
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目
3.下列表述正确的是( )
①某物质经科学测定只含有一种元素,不可以断定该物质一定是一种纯净物;
②过量铁粉在氯气中燃烧生成FeCl2
③浓硝酸在光照条件下变黄,说明浓硝酸不稳定,生成的有色产物能溶于浓硝酸;
④医疗上用的“钡餐”其成分是碳酸钡,漂白粉的成分为次氯酸钙;
⑤高压钠灯发出的黄光射程远,透雾能力强,故可做航标灯
⑥能与酸反应的氧化物,一定是碱性氧化物.
①某物质经科学测定只含有一种元素,不可以断定该物质一定是一种纯净物;
②过量铁粉在氯气中燃烧生成FeCl2
③浓硝酸在光照条件下变黄,说明浓硝酸不稳定,生成的有色产物能溶于浓硝酸;
④医疗上用的“钡餐”其成分是碳酸钡,漂白粉的成分为次氯酸钙;
⑤高压钠灯发出的黄光射程远,透雾能力强,故可做航标灯
⑥能与酸反应的氧化物,一定是碱性氧化物.
| A. | ①②③ | B. | ①③⑤ | C. | ②④⑥ | D. | ②③⑤ |
4.下列各图中的大黑点代表原子序数从1~18号元素的原子实(原子实是原子除最外层电子后剩余的部分),小黑点代表未用于形成共价键的最外层电子,短线代表共价键.下列各图表示的结构与化学式一定不相符的是( )
| A | B | C | D |
 |  |  |  |
| NH3 | C2H2 | CCl4 | CO2 |
| A. | A、 | B. | B | C. | C | D. | D |
18.下列各组物质,不能按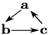 (“→”表示反应一步完成)关系转化的是( )
(“→”表示反应一步完成)关系转化的是( )
 (“→”表示反应一步完成)关系转化的是( )
(“→”表示反应一步完成)关系转化的是( )| 选项 | a | b | c |
| A | NO | NO2 | HNO3 |
| B | SiO2 | Na2SiO3 | H2SiO3 |
| C | Al | NaAlO2 | Al(OH)3 |
| D | MgCl2 | Mg(OH)2 | MgO |
| A. | A | B. | B | C. | C | D. | D |
5.1mol•L-1H2SO4溶液的含义是( )
| A. | 1 L水中含有1 mol H2SO4 | |
| B. | 1 L溶液中含有1 mol H+ | |
| C. | 将98 g H2SO4溶于1 L水中配成溶液 | |
| D. | 1 L H2SO4溶液中含98 g H2SO4 |
2.某溶液中含有CO32-、Cl-、Na+、NO3-四种离子,若向其中通入足量的HCl气体(溶液体积变化忽略不计).溶液中离子浓度保持不变的是( )
| A. | CO32-、NO3- | B. | Na+、Cl- | C. | Na+、NO3- | D. | Cl-、Na+、NO3- |
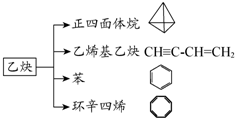 乙炔是一种重要的有机合成原料,以乙炔为原料在不同的反应条件下可以转化成如图所示的各种有机化合物.请回答下列问题:
乙炔是一种重要的有机合成原料,以乙炔为原料在不同的反应条件下可以转化成如图所示的各种有机化合物.请回答下列问题: -CH=CH2、
-CH=CH2、 的反应为取代反应
的反应为取代反应