题目内容
18.下列各组物质,不能按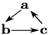 (“→”表示反应一步完成)关系转化的是( )
(“→”表示反应一步完成)关系转化的是( )| 选项 | a | b | c |
| A | NO | NO2 | HNO3 |
| B | SiO2 | Na2SiO3 | H2SiO3 |
| C | Al | NaAlO2 | Al(OH)3 |
| D | MgCl2 | Mg(OH)2 | MgO |
| A. | A | B. | B | C. | C | D. | D |
分析 一步反应实现即原物质只发生一个反应即可转化为目标物质,根据所涉及物质的性质,分析能否只通过一个反应而实现即可,
A.一氧化氮和氧气反应生成二氧化氮,二氧化氮和水反应生成硝酸,稀硝酸硝酸和金属反应生成一氧化氮;
B.二氧化硅和氢氧化钠溶液反应生成硅酸钠,硅酸钠和盐酸反应生成硅酸沉淀,硅酸受热分解生成二氧化硅;
C.铝和氢氧化钠溶液反应生成偏铝酸钠,偏铝酸钠溶液中通入二氧化碳生成氢氧化铝沉淀,氢氧化铝不能一步生成金属铝,需要分解生成的氧化铝电解得到金属铝;
D.氯化镁和氢氧化钠溶液反应生成氢氧化镁沉淀,氢氧化镁受热分解生成氧化镁,氧化镁和盐酸反应生成氯化镁.
解答 解:A.2NO+O2=2NO2,3NO2+H2O=2HNO3+NO,3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,能实现转化,故A正确;
B.SiO2+2NaOH=Na2SiO3+H2O,Na2SiO3+2HCl=2NaCl+H2SiO3↓,H2SiO3$\frac{\underline{\;\;△\;\;}}{\;}$SiO2+H2O,能实现转化,故B正确;
C.2Al+2NaOH+2H2O=2NaAlO2+3H2↑,NaAlO2+CO2+H2O=NaHCO3+Al(OH)3↓,氢氧化铝不能一步到金属铝,故C错误;
D.MgCl2+2NaOH=Mg(OH)2↓+2NaCl,Mg(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$MgO+H2O,MgO+2HCl=MgCl2+H2O,能实现转化,故D正确;
故选C.
点评 本题有一定难度,熟练掌握所涉及物质的性质、抓住关键词“能否一步实现”是解决此类问题的关键.

练习册系列答案
相关题目
8.为研究某铁钉与浓硫酸反应生成气体Y的成分,某学习小组做出假设,认为所得气体中除含有SO2外,还可能含有H2和Q气体,并设计了下列实验装置(图中夹持仪器省略)探究气体的成分,为确认Q的存在,需在装置中添加M于( )


| A. | A-B之前 | B. | B-C间 | C. | C-D间 | D. | D-E间 |
9.我国纳米专家王雪发明的“WXP复合纳米材料”主要化学成分是氨基二氯代戊二醛的含硅衍生物,它能保持长期杀菌作用.鉴于此,可将此新技术应用到人民币制造中去,以应用纳米新材料给人民币进行杀菌、消毒.该材料属于( )
| A. | 耐高温材料 | B. | 耐压材料 | C. | 复合材料 | D. | 耐腐蚀材料 |
13.设NA为阿伏加德罗常数的值,下列叙述中正确的是( )
| A. | 1mol丙烷分子中,含有的非极性共价键数目为NA | |
| B. | 标准状况下,1.8gH2O分子中所含有的电子数为NA | |
| C. | 25℃时,pH=13的 Ba(OH)2溶液中含有的OH-数目为0.1 NA | |
| D. | 2.24L 氯气与过量的氢氧化钠溶液完全反应转移的电子数为0.1NA |
10.下列关于硫及其化合物的说法中正确的是( )
| A. | SO2和Cl2混合通入水中后可能使品红褪色 | |
| B. | 二氧化硫的排放会导致光化学烟雾和酸雨的产生 | |
| C. | 单质硫在自然界只以化合态存在 | |
| D. | 浓硫酸可用来干燥SO2、CO、Cl2等气体 |
7.在一定条件下,7g炭粉与14g氧气完全反应生成21g氧化物,则生成物中CO与CO2的物质的量之比是( )
| A. | 1:1 | B. | 2:1 | C. | 2:3 | D. | 3:2 |
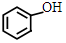 ;
; .
.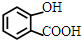 +NaHCO3→
+NaHCO3→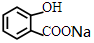 +CO2↑+H2O.
+CO2↑+H2O.