题目内容
20.下列说法正确的是( )| A. | 1L水中溶解了58.5g NaCl,该溶液的物质的量浓度为1mol/L | |
| B. | V L Fe2(SO4)3溶液中含a g SO42-,取此溶液$\frac{V}{2}$ L用水稀释成2V L,则稀释后溶液的c(Fe3+)为$\frac{a}{576V}$ mol/L | |
| C. | 已知某NaCl溶液的密度是1.17 g/cm3,可求出此溶液的物质的量浓度 | |
| D. | 把100mL20%的NaOH溶液跟100mL10%的NaOH 混合后,可判断NaOH混合溶液的质量分数等于15% |
分析 A、c=$\frac{n}{V}$中的V是溶液的体积,而不是溶剂的体积;
B、根据n=$\frac{m}{M}$计算a g SO42-的物质的量,VmL溶液中n(Fe3+)=$\frac{2}{3}$n(SO42-),进而计算$\frac{V}{2}$ L溶液中n(Fe3+),再根据c=$\frac{n}{V}$计算稀释后溶液中Fe3+的物质的量浓度;
C、质量分数不知无法,求溶液的物质的量浓度;
D、等体积混合是在等质量混合的基础上加上密度大.
解答 解:A、c=$\frac{n}{V}$中的V是溶液的体积,而不是溶剂的体积,故A错误;
B、a g SO42-的物质的量为$\frac{ag}{96g/mol}$=$\frac{a}{96}$mol,VL溶液中n(Fe3+)=$\frac{2}{3}$n(SO42-)=$\frac{2}{3}$×$\frac{a}{96}$mol,则$\frac{V}{2}$L溶液中n(Fe3+)=$\frac{2}{3}$×$\frac{a}{96}$mol×$\frac{1}{2}$=$\frac{a}{3×96}$mol,稀释后溶液中Fe3+的物质的量浓度为$\frac{\frac{a}{288}}{2V}$=为$\frac{a}{576V}$ mol/L,故B正确;
C、质量分数不知无法,求溶液的物质的量浓度,故C错误;
D、等质量混合后质量分数为15%,加上密度大的,所以混合后质量分数在15%~20%之间,故D错误.
故选:B.
点评 本题考查物质的量浓度与质量分数混合计算,注意溶液混合体积不具备加合性,注意对公式的理解与灵活应用,侧重对基础知识的巩固,难度不大.

练习册系列答案
相关题目
15.使用胆矾(CuSO4•5H2O)配制0.1mol/L的硫酸铜溶液,正确的操作是( )
| A. | 将胆矾加热除去结晶水后,称取16g溶解在1L水中 | |
| B. | 称取25g胆矾溶于水,然后将此溶液稀释至1L | |
| C. | 称取25g胆矾溶解在1L水里 | |
| D. | 将16g胆矾溶于水,然后将此溶液稀释至1L |
9.在25℃时,将a mol/L的氨水与0.01mol/L的HCl溶液等体积混合,反应后溶液呈中性,下列说法不正确的是(忽略溶液混合后体积的变化)( )
| A. | 此时水的电离程度最大 | |
| B. | 溶液中c(NH${\;}_{4}^{+}$)=c(Cl-) | |
| C. | 此时溶液中NH3•H2O的物质的量浓度为$\frac{1}{2}$(a-0.01)mol/L | |
| D. | 用含a的代数式表示NH3•H2O的电离常数Kb=$\frac{1{0}^{-9}}{a-0.01}$ |
10.下列有关有机物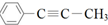 的描述正确的是( )
的描述正确的是( )
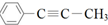 的描述正确的是( )
的描述正确的是( )| A. | 该有机物中只含有非极性键 | |
| B. | 该有机物与溴水的加成产物只有1种 | |
| C. | 该分子中最多有10个原子共平面 | |
| D. | 该分子中最多有5个碳原子共直线 |
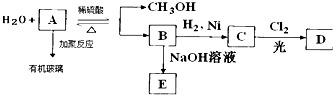
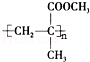 .
. CH3OH+CH2=C(CH3)COOH.
CH3OH+CH2=C(CH3)COOH.