题目内容
在0.25摩尔硫酸钠中,含有的氧原子个数为( )
| A、1 |
| B、0.25 |
| C、6.02×1023 |
| D、5×1023 |
考点:物质分子中的原子个数计算
专题:阿伏加德罗常数和阿伏加德罗定律
分析:由化学式可知,1molNa2SO4中含4molO,结合N=nNA计算.
解答:
解:由化学式可知,1molNa2SO4中含4molO,则0.25molNa2SO4中,n(O)=0.25mol×4=1mol,含有的氧原子个数约为6.02×1023,
故选C.
故选C.
点评:本题考查物质的量的计算,把握物质的构成及物质的量与微粒数的关系为解答的关键,题目较简单.

练习册系列答案
 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案
相关题目
下列离子组能够大量共存的是( )
| A、H+、HCO3-、NO3-、Cl- |
| B、K+、Na+、NH4+、OH- |
| C、Na+、I-、NO3-、SO42- |
| D、Fe3+、Na+、S2-、CO32- |
下列物质中不存在手性异构体的是( )
| A、CH3COOCH2CH3 |
| B、BrCH2CHOHCH2OH |
| C、CH3CHOHCOOH |
D、 |
能正确表示下列反应的离子方程式是( )
| A、硅酸钠溶液与醋酸溶液混合:SiO32-+2H+=H2SiO3↓ | ||
| B、钠与水反应:2Na+2H2O=2Na++2OH-+H2↑ | ||
C、将氯化亚铁溶液和稀硝酸混合:Fe2++4H++NO
| ||
| D、将铁粉加入稀硫酸中:2Fe+6H+=2Fe3++3H2↑ |
已知:N2(g)+3H2(g)?2NH3(g)△H=-92kJ/mol,相关数据如下
一定条件下,在体积为1L的密闭容器中加入1molN2和3molH2充分反应,放出热量Q1kJ,下列说法正确的是( )
| H2(g) | N2(g) | NH3(g) | |
| 1mol分子中的化学键形成时要释放出的能量/kJ | 436 | 946 | a |
A、如图可表示合成氨过程中的能量变化 |
| B、a的数值为391 |
| C、Q1的数值为92 |
| D、相同条件下,反应物若为2molN2和6molH2,放出热量Q2>2Q1 |
 一种新型的乙醇电池(DEFC)用磺酸类质子溶剂,在200℃左右时供电,乙醇电池比甲醇电池效率高出32倍且更安全.电池总反应为:C2H5OH+3O2═2CO2+3H2O.下列说法不正确的是( )
一种新型的乙醇电池(DEFC)用磺酸类质子溶剂,在200℃左右时供电,乙醇电池比甲醇电池效率高出32倍且更安全.电池总反应为:C2H5OH+3O2═2CO2+3H2O.下列说法不正确的是( )| A、a极为电池的正极 |
| B、电池工作时电流由b极沿导线经灯泡再到a极 |
| C、电池正极的电极反应为:4H++O2+4e-═2H2O |
| D、每消耗1 mol乙醇,反应中转移电子数为6 NA |
已知甲酸(HCOOH)是一种酸性比CH3COOH强的弱酸,则在稀甲酸钠溶液中加入下列粒子后会使溶液中的甲酸浓度增大的是(忽略掉溶液体积的交化)( )
A、 | ||
B、 | ||
C、
| ||
| D、CH3CH2OH |
下列物质按只含离子键、只含共价键、既含离子键又含共价键的顺序排列的是( )
| A、氯气 二氧化碳 氢氧化钠 |
| B、氯化钠 过氧化钠 氯化铵 |
| C、氯化钠 过氧化氢 氯化铵 |
| D、氯化钠 氦气 氢氧化钠 |
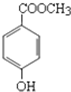 尼泊金酯是一种高效食品防腐剂,其结构简式为:
尼泊金酯是一种高效食品防腐剂,其结构简式为: