题目内容
18.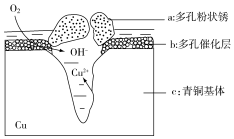 青铜器的制造是中华民族劳动人民智慧的结晶,成为一个时代的象征,但出土的青铜器大多受到环境腐蚀.如图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图.环境中的 Cl- 扩散到孔口,并与各电极产物作用生成多孔粉状锈 Cu2(OH)3Cl.下列说法不正确的是( )
青铜器的制造是中华民族劳动人民智慧的结晶,成为一个时代的象征,但出土的青铜器大多受到环境腐蚀.如图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图.环境中的 Cl- 扩散到孔口,并与各电极产物作用生成多孔粉状锈 Cu2(OH)3Cl.下列说法不正确的是( )| A. | 腐蚀过程中,负极c被氧化 | |
| B. | 环境中的Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为2Cu2++3OH-+Cl-═Cu2(OH)3Cl↓ | |
| C. | 若生成 2.145 g Cu2(OH)3Cl,则理论上消耗标准状况氧气体积为 0.448 L | |
| D. | 正极的电极反应式为:O2+4e-+2H2O═4OH- |
分析 A、根据图知,氧气得电子生成氢氧根离子、Cu失电子生成铜离子,发生吸氧腐蚀,则Cu作负极被氧化;
B、Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,负极上生成铜离子、正极上生成氢氧根离子,所以该离子反应为氯离子、铜离子和氢氧根离子反应生成Cu2(OH)3Cl沉淀;
C、n[Cu2(OH)3Cl]=$\frac{2.145g}{214.5g/mol}$=0.01mol,根据转移电子计算氧气物质的量,再根据V=nVm计算体积;
D、氧气得电子生成氢氧根离子;
解答 解:A、根据图知,氧气得电子生成氢氧根离子、Cu失电子生成铜离子,发生吸氧腐蚀,则Cu作负极被氧化,腐蚀过程中,负极是c,故A正确;
B、Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,负极上生成铜离子、正极上生成氢氧根离子,所以该离子反应为氯离子、铜离子和氢氧根离子反应生成Cu2(OH)3Cl沉淀,离子方程式为2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓,故B正确;
C、n[Cu2(OH)3Cl]=$\frac{2.145g}{214.5g/mol}$=0.01mol,根据转移电子得n(O2)=$\frac{0.01×2×2}{4}$=0.01mol,消耗标准状况氧气体积为 0.224 L,故C错误;
D、氧气在正极得电子生成氢氧根离子,电极反应式为:O2+4e-+2H2O=4OH-,故D正确;
故选:C.
点评 本题考查了原电池原理及电极反应式、电池反应式的书写及其计算,难度中等,掌握原理是解题关键.

练习册系列答案
相关题目
18.下列图示与对应的叙述相符的是( )
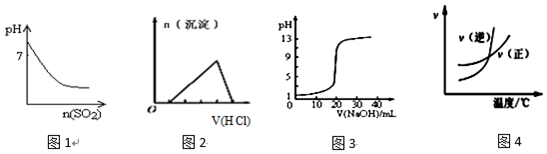

| A. | 图1表示将SO2气体通入溴水中,所得溶液的pH变化 | |
| B. | 图2表示向含有少量氢氧化钠的偏铝酸钠溶液中滴加盐酸所得沉淀的物质的量与盐酸体积的关系 | |
| C. | 图3表示常温下,向0.1000mol•L-1HCl溶液中滴加20.00mL 0.1000mol•L-1氨水的滴定曲线 | |
| D. | 图4表示乙醇的催化氧化反应中速率随温度的变化图象,升高温度该反应的平衡常数减小 |
13.下列说法正确的是( )
| A. | 加入过量氨水,有白色沉淀生成,则原溶液中一定有Al3+ | |
| B. | 加入盐酸酸化的BaCl2溶液,有白色沉淀生成,则原溶液一定有SO42- | |
| C. | 向某溶液中先加入氯水振荡,再加KSCN溶液后显血红色,该溶液中一定有Fe2+ | |
| D. | 向某溶液中先加入新制饱和氯水,再加CCl4,振荡,分层,下层呈橙红色,则该溶液中一定含有Br- |
3.元素X与元素Y在周期表中位于相邻的两个周期,X与Y两原子核外电子数之和为19,Y原子核内质子数比X多3个.下列描述正确的是( )
| A. | X和Y都是性质活泼的元素,在自然界中只能以化合态存在 | |
| B. | X和Y形成的化合物的化学式可能为Y2X2 | |
| C. | X的化合物种类比Y的化合物种类少 | |
| D. | Y能置换酸中氢放出氢气,但不能置换盐中的金属 |
10.4种相邻主族短周期元素的相对位置如表,元素x的原子核外电子数是m的2倍,y的氧化物具有两性.
回答下列问题:
(1)元素x在周期表中的位置是第三周期第ⅡA族,其单质可采用电解熔融MgCl2的方法制备.
(2)气体分子(mn)2的电子式为 ,(mn)2称为拟卤素,性质与卤素相似,其与氢氧化钠溶液反应的化学方程式为2NaOH+(CN)2=NaCN+NaOCN+H2O.
,(mn)2称为拟卤素,性质与卤素相似,其与氢氧化钠溶液反应的化学方程式为2NaOH+(CN)2=NaCN+NaOCN+H2O.
(3)已知氰化钠(NaCN),可以与很多金属形成络合物,因此工业上采用氰化法提炼金:用稀的氰化钠溶液处理粉碎了的金矿石,通入空气,使金矿石中的金粒溶解,生成能溶于水的络合物Na[Au(CN)2],其反应方程式为:①4Au+8NaCN+2H2O+O2═4Na[Au(CN)2]+4NaOH,Na[Au(CN)2]在水溶液中的电离方程式为:②Na[Au(CN)2]═Na++[Au(CN)2]-
然后再用锌从溶液中把金置换出来,锌转化为Na2[Zn(CN)4].据此,请利用①写出在空气中用氰化钠溶液提取金的电极反应式:正极:O2+2H2O+4e-═4OH-,负极:Au+2CN--e-═[Au(CN)2]-.
(4)若人不慎氰化钠中毒,可用Na2S2O3缓解,二者反应得到两种含硫元素的离子,其中一种遇到Fe3+可变为红色.写出解毒原理的相关离子方程式S2O32-+CN-═SCN-+SO32-.
| m | n | ||
| x | y |
(1)元素x在周期表中的位置是第三周期第ⅡA族,其单质可采用电解熔融MgCl2的方法制备.
(2)气体分子(mn)2的电子式为
 ,(mn)2称为拟卤素,性质与卤素相似,其与氢氧化钠溶液反应的化学方程式为2NaOH+(CN)2=NaCN+NaOCN+H2O.
,(mn)2称为拟卤素,性质与卤素相似,其与氢氧化钠溶液反应的化学方程式为2NaOH+(CN)2=NaCN+NaOCN+H2O.(3)已知氰化钠(NaCN),可以与很多金属形成络合物,因此工业上采用氰化法提炼金:用稀的氰化钠溶液处理粉碎了的金矿石,通入空气,使金矿石中的金粒溶解,生成能溶于水的络合物Na[Au(CN)2],其反应方程式为:①4Au+8NaCN+2H2O+O2═4Na[Au(CN)2]+4NaOH,Na[Au(CN)2]在水溶液中的电离方程式为:②Na[Au(CN)2]═Na++[Au(CN)2]-
然后再用锌从溶液中把金置换出来,锌转化为Na2[Zn(CN)4].据此,请利用①写出在空气中用氰化钠溶液提取金的电极反应式:正极:O2+2H2O+4e-═4OH-,负极:Au+2CN--e-═[Au(CN)2]-.
(4)若人不慎氰化钠中毒,可用Na2S2O3缓解,二者反应得到两种含硫元素的离子,其中一种遇到Fe3+可变为红色.写出解毒原理的相关离子方程式S2O32-+CN-═SCN-+SO32-.
8.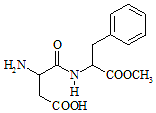 阿斯巴甜(Aspartame,结构简式如图所示)具有清爽的甜味,甜度约为蔗糖的200倍.下列有关说法正确的是( )
阿斯巴甜(Aspartame,结构简式如图所示)具有清爽的甜味,甜度约为蔗糖的200倍.下列有关说法正确的是( )
 阿斯巴甜(Aspartame,结构简式如图所示)具有清爽的甜味,甜度约为蔗糖的200倍.下列有关说法正确的是( )
阿斯巴甜(Aspartame,结构简式如图所示)具有清爽的甜味,甜度约为蔗糖的200倍.下列有关说法正确的是( )| A. | 分子式为C14H18N2O3,阿斯巴甜不属于蛋白质 | |
| B. | 阿斯巴甜的水解产物中只有一种氨基酸 | |
| C. | 阿斯巴甜在一定条件下不能与酸反应、只能与碱反应 | |
| D. | 阿斯巴甜分子中有3个手性碳原子 |