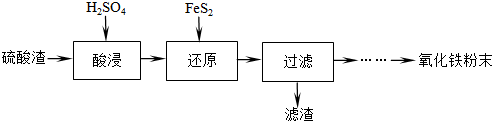
题目内容
工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁[Fe(OH)SO4]的工艺流程如下:

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如下表:
回答下列问题:
(1)加入过量废铁屑的目的是 .
(2)加入少量NaHCO3的目的是调节pH,使溶液中的 (选填“Fe3+”、“Fe2+”或“Al3+”)沉淀.该工艺流程中“搅拌”的作用是 .
(3)反应Ⅱ的离子方程式为 .在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中均作 .若参与反应的O2有11.2L(标准状况),则相当于节约NaNO2的物质的量为 .
(4)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,可部分水解生成Fe2(OH)42+聚合离子.该水解反应的离子方程式为 .
(5)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁.根据我国质量标准,产品中不得含有Fe2+及NO3-.为检验所得产品中是否含有Fe2+,应使用的试剂为 .
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液
(6)将11.9g Mg、Al、Fe组成的合金溶于足量的NaOH溶液中,合金质量减少了2.7g.另取等质量的合金溶于过量稀硝酸中,生成了6.72L(标准状况下)NO,向反应后的溶液中加入适量NaOH溶液恰好使Mg2+、Al3+、Fe3+完全转化为沉淀,则沉淀质量为 .
A.22.1g B.27.2g C.30g D.无法确定.

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
(1)加入过量废铁屑的目的是
(2)加入少量NaHCO3的目的是调节pH,使溶液中的
(3)反应Ⅱ的离子方程式为
(4)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,可部分水解生成Fe2(OH)42+聚合离子.该水解反应的离子方程式为
(5)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁.根据我国质量标准,产品中不得含有Fe2+及NO3-.为检验所得产品中是否含有Fe2+,应使用的试剂为
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液
(6)将11.9g Mg、Al、Fe组成的合金溶于足量的NaOH溶液中,合金质量减少了2.7g.另取等质量的合金溶于过量稀硝酸中,生成了6.72L(标准状况下)NO,向反应后的溶液中加入适量NaOH溶液恰好使Mg2+、Al3+、Fe3+完全转化为沉淀,则沉淀质量为
A.22.1g B.27.2g C.30g D.无法确定.
考点:制备实验方案的设计,物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:废铁屑中含少量氧化铝、氧化铁等,将过量废铁屑加入稀硫酸中,发生反应 Fe+H2SO4=FeSO4+H2↑、Al2O3+3H2SO4=Al2(SO4)3+3H2O、Fe2O3+3H2SO4=Fe2(SO4)3+3H2O、Fe2(SO4)3+Fe=3FeSO4,然后反应I中加入NaHCO3并搅拌,调节溶液的pH,发生反应Al3++3HCO3-=Al(OH)3↓+3CO2↑,所以滤渣中成分是Al(OH)3,过滤得到硫酸亚铁,向硫酸亚铁溶液中加入稀硫酸和NaNO2,酸性条件下,NaNO2和FeSO4发生氧化还原反应生成铁离子、NO,将溶液蒸发浓缩、过滤得到碱式硫酸铁,据此分析解答.
(1)Fe为活泼金属,可与酸反应,氧化铁与酸反应生成铁离子,铁离子可以氧化Fe;
(2)要制备硫酸亚铁,应与硫酸铝分离,根据沉淀的pH选择;搅拌可以加快反应速率;
(3)依据流程分析判断,反应Ⅱ是亚硝酸根离子氧化亚铁离子便于铁离子沉淀分离,流程产物分析可知O2与NaNO2在反应中做氧化剂;依据电子守恒计算;
(4)根据反应物和生成物判断离子方程式,Fe(OH)2+水解显酸性,据电荷守恒可写出该反应的离子方程式;
(5)亚铁离子具有还原性能使酸性高锰酸钾溶液褪色;
(6)根据电子守恒计算出金属失去电子的物质的量,根据反应中金属失去电子的物质的量等于生成碱的氢氧根离子的物质的量,从金属单质转化为其氢氧化物,增加的是氢氧根离子的质量来计算生成沉淀的质量.
(1)Fe为活泼金属,可与酸反应,氧化铁与酸反应生成铁离子,铁离子可以氧化Fe;
(2)要制备硫酸亚铁,应与硫酸铝分离,根据沉淀的pH选择;搅拌可以加快反应速率;
(3)依据流程分析判断,反应Ⅱ是亚硝酸根离子氧化亚铁离子便于铁离子沉淀分离,流程产物分析可知O2与NaNO2在反应中做氧化剂;依据电子守恒计算;
(4)根据反应物和生成物判断离子方程式,Fe(OH)2+水解显酸性,据电荷守恒可写出该反应的离子方程式;
(5)亚铁离子具有还原性能使酸性高锰酸钾溶液褪色;
(6)根据电子守恒计算出金属失去电子的物质的量,根据反应中金属失去电子的物质的量等于生成碱的氢氧根离子的物质的量,从金属单质转化为其氢氧化物,增加的是氢氧根离子的质量来计算生成沉淀的质量.
解答:
解:废铁屑中含少量氧化铝、氧化铁等,将过量废铁屑加入稀硫酸中,发生反应 Fe+H2SO4=FeSO4+H2↑、Al2O3+3H2SO4=Al2(SO4)3+3H2O、Fe2O3+3H2SO4=Fe2(SO4)3+3H2O、Fe2(SO4)3+Fe=3FeSO4,然后反应I中加入NaHCO3并搅拌,调节溶液的pH,发生反应Al3++3HCO3-=Al(OH)3↓+3CO2↑,所以滤渣中成分是Al(OH)3,过滤得到硫酸亚铁,向硫酸亚铁溶液中加入稀硫酸和NaNO2,酸性条件下,NaNO2和FeSO4发生氧化还原反应生成铁离子、NO,将溶液蒸发浓缩、过滤得到碱式硫酸铁,
(1)加入过量废铁屑的目的是,使硫酸充分反应掉、提高硫酸利用率或使Fe3+尽可能转化为Fe2+;
故答案为:使硫酸充分反应掉、提高硫酸利用率或使Fe3+尽可能转化为Fe2+;
(2)由题意可知,过量废铁屑溶于稀硫酸得FeSO4、Al2(SO4)3混合溶液,根据表中数据可知,向混合溶液中加入少量NaHCO3,沉淀Al3+而不沉淀Fe2+,反应方程式为Al3++3HCO3-=Al(OH)3↓+3CO2↑,制备硫酸亚铁,应与硫酸铝分离,应调节溶液pH生成Al(OH)3,要避免生成应Fe(OH)2沉淀,控制pH在4.4~7.5之间;工艺中搅拌作用是加快反应速率(或使反应物充分接触);
故答案为:Al3+;加快反应速率(或使反应物充分接触);
(3)反应Ⅱ是亚硝酸根离子氧化亚铁离子生成NO和三价铁离子,其离子方程式为:Fe2++NO2-+2H+=Fe3++NO↑+H2O,流程产物分析可知O2与NaNO2在反应中做氧化剂;n(O2)=
=0.5mol,则得到电子0.5mol×4=2mol,1molNaNO2被还原生成NO,化合价由+3价降低到+2价,得到2mol电子,NaNO2的物质的量为 2mol,
故答案为:Fe2++NO2-+2 H+=Fe3++NO↑+H2O;氧化剂;2mol;
(4)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,Fe(OH)2+可部分水解生成Fe2(OH)42+聚合离子,该水解反应的离子方程式为 2Fe(OH)2++2H2O?Fe2(OH)42++2H+;
故答案为:2Fe(OH)2++2H2O?Fe2(OH)42++2H+;
(5)亚铁离子具有还原性,能被强氧化剂氧化生成铁离子,反应过程中颜色变化明显的效果最佳,
A.氯水为浅黄绿色,氯气将亚铁离子氧化为铁离子,溶液呈黄色,颜色变化不明显,故A不选;
B.KSCN溶液和亚铁离子不反应,没有颜色变化,故B不选;
C.NaOH溶液和亚铁离子反应生成白色沉淀,铁离子和氢氧根离子反应生成红褐色沉淀,掩盖氢氧化亚铁颜色,故C不选;
D.酸性KMnO4溶液呈紫色,亚铁离子能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,现象明显,故D选;
故选D;
(6)将合金溶于过量稀硝酸中,分别生成Al3+、Fe3+、Mg2+离子,根据电子守恒,金属共失去电子的物质的量和氮原子得电子的量是相等的,生成了6.72L NO,即氮原子得电子的物质的量是
(5-2)=0.9mol,根据前后发生的整个过程的反应,知道反应中金属失去电子的物质的量等于生成碱的氢氧根离子的物质的量,即n(OH-)=0.9mol,从金属单质转化为其氢氧化物,增加的是氢氧根离子的质量,所以反应后沉淀的质量(包括氢氧化铝),为11.9g+0.9mol×17g/mol=27.2g,
故答案为:B.
(1)加入过量废铁屑的目的是,使硫酸充分反应掉、提高硫酸利用率或使Fe3+尽可能转化为Fe2+;
故答案为:使硫酸充分反应掉、提高硫酸利用率或使Fe3+尽可能转化为Fe2+;
(2)由题意可知,过量废铁屑溶于稀硫酸得FeSO4、Al2(SO4)3混合溶液,根据表中数据可知,向混合溶液中加入少量NaHCO3,沉淀Al3+而不沉淀Fe2+,反应方程式为Al3++3HCO3-=Al(OH)3↓+3CO2↑,制备硫酸亚铁,应与硫酸铝分离,应调节溶液pH生成Al(OH)3,要避免生成应Fe(OH)2沉淀,控制pH在4.4~7.5之间;工艺中搅拌作用是加快反应速率(或使反应物充分接触);
故答案为:Al3+;加快反应速率(或使反应物充分接触);
(3)反应Ⅱ是亚硝酸根离子氧化亚铁离子生成NO和三价铁离子,其离子方程式为:Fe2++NO2-+2H+=Fe3++NO↑+H2O,流程产物分析可知O2与NaNO2在反应中做氧化剂;n(O2)=
| 11.2L |
| 22.4L/mol |
故答案为:Fe2++NO2-+2 H+=Fe3++NO↑+H2O;氧化剂;2mol;
(4)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,Fe(OH)2+可部分水解生成Fe2(OH)42+聚合离子,该水解反应的离子方程式为 2Fe(OH)2++2H2O?Fe2(OH)42++2H+;
故答案为:2Fe(OH)2++2H2O?Fe2(OH)42++2H+;
(5)亚铁离子具有还原性,能被强氧化剂氧化生成铁离子,反应过程中颜色变化明显的效果最佳,
A.氯水为浅黄绿色,氯气将亚铁离子氧化为铁离子,溶液呈黄色,颜色变化不明显,故A不选;
B.KSCN溶液和亚铁离子不反应,没有颜色变化,故B不选;
C.NaOH溶液和亚铁离子反应生成白色沉淀,铁离子和氢氧根离子反应生成红褐色沉淀,掩盖氢氧化亚铁颜色,故C不选;
D.酸性KMnO4溶液呈紫色,亚铁离子能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,现象明显,故D选;
故选D;
(6)将合金溶于过量稀硝酸中,分别生成Al3+、Fe3+、Mg2+离子,根据电子守恒,金属共失去电子的物质的量和氮原子得电子的量是相等的,生成了6.72L NO,即氮原子得电子的物质的量是
| 6.72L |
| 22.4L/mol |
故答案为:B.
点评:本题考查物质的分离和提纯,侧重考查学生获取信息及利用信息能力、分析能力、实验操作能力,注意题给信息的灵活运用,知道常见离子的检验方法及现象,题目难度中等.

练习册系列答案
相关题目
下列说法正确的是( )
| A、将AlCl3溶液和Al2(SO4)3溶液分别加热、蒸干、灼烧,所得固体成分相同 |
| B、配制FeSO4溶液时,将FeSO4固体溶于稀盐酸中,然后稀释至所需浓度 |
| C、草木灰可以与铵态氮肥混合使用 |
| D、高铁酸钠(Na2FeO4)能应用于饮用水消毒并净化水 |
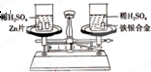 如图所示,在托盘天平的左右两托盘中各放置一只烧杯,调节天平使之平衡,向烧杯中分别注入足量且等质量、等浓度的稀硫酸,然后向两只烧杯中分别加入相同质量的锌片和铁银合金,反应完成后,天平仍保持平衡.合金中铁和银的质量比为( )
如图所示,在托盘天平的左右两托盘中各放置一只烧杯,调节天平使之平衡,向烧杯中分别注入足量且等质量、等浓度的稀硫酸,然后向两只烧杯中分别加入相同质量的锌片和铁银合金,反应完成后,天平仍保持平衡.合金中铁和银的质量比为( )| A、65:56 | B、56:108 |
| C、56:9 | D、65:9 |
下列叙述正确的是( )
| A、将氯化铁饱和溶液逐滴滴入氢氧化钠稀溶液中,边滴边搅拌,可获得氢氧化铁胶体 |
| B、不能用乙醇萃取碘水中的碘是因为碘在水中溶解度比在乙醇中大 |
| C、实验室可通过蒸馏的方法除去自来水中含有的氯离子等杂质制蒸馏水 |
| D、浓硫酸不慎溅到皮肤上,应该立即用大量水冲洗,然后涂上稀NaOH溶液 |
下列说法错误的是( )
| A、钠是电和热的良导体 |
| B、饱和溶液的碱性:NaHCO3大于Na2CO3 |
| C、明矾净水是由于明矾在水中形成Al(OH)3胶体具有吸附作用 |
| D、某溶液焰色反应时,如果火焰呈黄色就说明该溶液一定有钠元素,可能有钾元素 |