题目内容
 用标签如图的浓硫酸配得200mL某浓度的稀硫酸,现将27.2g铁粉和氧化铁的混合物加入其中,恰好完全反应,放出氢气2.24L(标准状况).反应后的溶液中滴加KSCN不显红色,且无固体剩余物,求:(计算结果保留小数点后1位)
用标签如图的浓硫酸配得200mL某浓度的稀硫酸,现将27.2g铁粉和氧化铁的混合物加入其中,恰好完全反应,放出氢气2.24L(标准状况).反应后的溶液中滴加KSCN不显红色,且无固体剩余物,求:(计算结果保留小数点后1位)①配制200mL该稀硫酸,需要浓硫酸
②混合物中氧化铁的质量为
③稀硫酸的物质的量浓度为
考点:化学方程式的有关计算
专题:计算题
分析:①浓硫酸物质的量浓度=
mol/L,根据原子守恒和转移电子守恒计算铁和氧化铁的物质的量,铁和氧化铁与硫酸完全反应后都生成硫酸亚铁,根据原子守恒计算硫酸的物质的量,再根据V=
计算浓硫酸体积;
②m(Fe2O3)=n(Fe2O3).M(Fe2O3);
③根据浓硫酸稀释前后物质的量不变计算稀硫酸浓度.
| 103ρw |
| M |
| n |
| c |
②m(Fe2O3)=n(Fe2O3).M(Fe2O3);
③根据浓硫酸稀释前后物质的量不变计算稀硫酸浓度.
解答:
解:氢气的物质的量=
=0.1mol,浓硫酸物质的量浓度=
mol/L=
mol/L=18.4mol/L,
①将铁通入稀硫酸中发生的离子反应为:Fe+2H+=Fe2++H2↑、Fe2O3+6H+=2Fe3++3H2O、Fe+2Fe3+=3Fe2+,设铁的物质的量为x,氧化铁的物质的量为y,根据转移电子守恒及质量守恒得,根据铁和稀硫酸反应方程式知,生成0.1mol氢气需要铁的物质的量为0.1mol,
,
,
铁、氧化铁和硫酸完全反应后恰好反应生成FeSO4,根据原子守恒得n(H2SO4)=n(Fe)+2n(Fe2O3)=0.2mol+0.2mol=0.4mol,所以浓硫酸的体积=
=21.7mL,
故答案为:21.7;
②m(Fe2O3)=n(Fe2O3).M(Fe2O3)=0.1mol×160g/mol=16g,
故答案为:16;
③根据浓硫酸稀释前后物质的量不变,稀硫酸的物质的量浓度=
=2mol?L-1,故答案为:2.
| 2.24L |
| 22.4L/mol |
| 103ρw |
| M |
| 103×1.84×98% |
| 98 |
①将铁通入稀硫酸中发生的离子反应为:Fe+2H+=Fe2++H2↑、Fe2O3+6H+=2Fe3++3H2O、Fe+2Fe3+=3Fe2+,设铁的物质的量为x,氧化铁的物质的量为y,根据转移电子守恒及质量守恒得,根据铁和稀硫酸反应方程式知,生成0.1mol氢气需要铁的物质的量为0.1mol,
|
|
铁、氧化铁和硫酸完全反应后恰好反应生成FeSO4,根据原子守恒得n(H2SO4)=n(Fe)+2n(Fe2O3)=0.2mol+0.2mol=0.4mol,所以浓硫酸的体积=
| 0.4mol |
| 18.4mol/L |
故答案为:21.7;
②m(Fe2O3)=n(Fe2O3).M(Fe2O3)=0.1mol×160g/mol=16g,
故答案为:16;
③根据浓硫酸稀释前后物质的量不变,稀硫酸的物质的量浓度=
| 0.4mol |
| 0.2L |
点评:本题考查了物质的量的计算,明确发生的反应是解本题关键,再结合质量守恒及原子守恒计算铁及氧化铁的物质的量,最后根据物质之间的关系式解答,难度中等.

练习册系列答案
相关题目
牙齿表面由一层硬的成分为Ca5(PO4)3OH的物质保护,它在唾液中存在下列平衡:
Ca5(PO4)3OH(s)═5Ca2+ (aq)+3PO43- (aq)+OH-(aq)
已知Ca5(PO4)3F(s)的溶解度比Ca5(PO4)3OH(s)更小,以下措施中能保护牙齿的是( )
Ca5(PO4)3OH(s)═5Ca2+ (aq)+3PO43- (aq)+OH-(aq)
已知Ca5(PO4)3F(s)的溶解度比Ca5(PO4)3OH(s)更小,以下措施中能保护牙齿的是( )
| A、多饮纯净水 |
| B、在牙膏中添加适量的Ca2+或PO43-离子 |
| C、在饮用水中加入柠檬片 |
| D、在牙膏中加入适量的氟化物添加剂 |
下列离子方程式中,正确的是( )
| A、澄清石灰水与稀盐酸反应 Ca(OH)2+2H+═Ca2++2H2O |
| B、钠与水反应 Na+2H2O═Na++2OH-+H2↑ |
| C、Cl2与水反应 Cl2+H2O═Cl-+ClO-+2H+ |
| D、F2与NaOH溶液反应 2F2+4OH-═4F-+O2+2H2O |
下列关于各装置图的叙述中,不正确的是( )
A、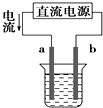 如图装置中a为阳极、b为阴极 |
B、 如图装置的总反应是:Cu+2Fe3+=Cu2++2Fe2+ |
C、 如图装置中X若为四氯化碳,可用于吸收氨气或氯化氢,并防止倒吸 |
D、 如图装置中的铁钉几乎不被腐蚀 |
下列有关热化学方程式书写及对应表述均正确的是( )
| A、密闭容器中,9.6g硫粉与11.2g铁粉混合加热生成硫化亚铁17.6g时,放出19.12kJ热量.则Fe(s)+S(s)═FeS(s)△H=-95.6kJ.mol-1 |
| B、稀醋酸与0.1mol?L-1NaOH溶液反应:H+(aq)+OH-(aq)═H2O(l)△H=57.3kJ?mol-1 |
| C、已知1mol氢气完全燃烧生成液态水所放出的热量为285.5kJ,则水分解的热化学方程式:2H2O(l)═2H2(g)+O2(g)△H=+285.5kJ.mol-1 |
| D、已知2C(s)+O2(g)═2CO(g)△H=-22.1kJ.mol-1则可知C的燃烧热△H=-110.5kJ.mol-1 |
 把18.0mol/L 的浓硫酸稀释成1.80mol/L 的稀硫酸100mL,实验操作如下:
把18.0mol/L 的浓硫酸稀释成1.80mol/L 的稀硫酸100mL,实验操作如下:


 氢氧燃料电池是符合绿色化学理念的新型发电装置,如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.
氢氧燃料电池是符合绿色化学理念的新型发电装置,如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.