题目内容
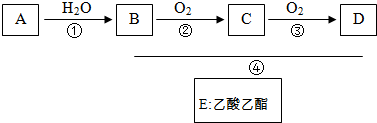
下列中学化学中常见物质的转化关系如图,反应条件及部分反应物和产物未全部注明,已知A、D为金属单质,其他为化合物.

(1)写出B的化学式 ;
(2)写出反应A+B→C+D的一种应用 ;
(3)写出过量的D与稀硝酸反应的离子方程式: ;
(4)H→I的化学方程式: ;
(5)某同学认为物质J 中可能同时含有同一金属元素的不同价态,若要确定其中低价阳离子的存在最好应选用 ;
A、KSCN溶液和氯水 B、铁粉和KSCN 溶液C、浓氨水 D、KMnO4溶液.

(1)写出B的化学式
(2)写出反应A+B→C+D的一种应用
(3)写出过量的D与稀硝酸反应的离子方程式:
(4)H→I的化学方程式:
(5)某同学认为物质J 中可能同时含有同一金属元素的不同价态,若要确定其中低价阳离子的存在最好应选用
A、KSCN溶液和氯水 B、铁粉和KSCN 溶液C、浓氨水 D、KMnO4溶液.
考点:无机物的推断
专题:推断题
分析:由B为红棕色粉末可知,B为Fe2O3,结合转化关系图可知,I为Fe(OH)3,H为Fe(OH)2,G为FeCl2,D为Fe,A+B→D+C为铝热反应,则A为Al,C为Al2O3,E为AlCl3,F为偏铝酸盐,所以试剂①为盐酸,试剂②为强碱(如NaOH或KOH等),结合化学用语来解答.
解答:
解:由B为红棕色粉末可知,B为Fe2O3,结合转化关系图可知,I为Fe(OH)3,H为Fe(OH)2,G为FeCl2,D为Fe,A+B→D+C为铝热反应,则A为Al,C为Al2O3,E为AlCl3,F为偏铝酸盐,所以试剂①为盐酸,试剂②为强碱(如NaOH或KOH等),
(1)根据上面的分析可知,B的化学式为Fe2O3,故答案为:Fe2O3;
(2)反应A+B→C+D为铝热反应,可以用来焊接铁轨、冶炼某些金属等,故答案为:焊接铁轨;
(3)写出过量的铁与稀硝酸反应生成亚铁离子,它的离子方程式为3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O,故答案为:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O;
(4)H为Fe(OH)2,I为Fe(OH)3,H→I的化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3,故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(5)物质J中可能同时含有Fe2+和Fe3+,若要确定其中Fe2+的存在,
A、由于有Fe3+的干扰,所以无法用KSCN溶液和氯水检验Fe2+的存在,故A错误;
B、铁粉和KSCN 溶液,只能检验Fe3+的存在,而不能检验Fe2+的存在,故B错误;
C、由于有Fe3+的干扰,浓氨水无法检验Fe2+的存在,故C错误;
D、Fe2+具有还原性,能使高锰酸钾溶液褪色,故D正确;
故选D.
(1)根据上面的分析可知,B的化学式为Fe2O3,故答案为:Fe2O3;
(2)反应A+B→C+D为铝热反应,可以用来焊接铁轨、冶炼某些金属等,故答案为:焊接铁轨;
(3)写出过量的铁与稀硝酸反应生成亚铁离子,它的离子方程式为3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O,故答案为:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O;
(4)H为Fe(OH)2,I为Fe(OH)3,H→I的化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3,故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(5)物质J中可能同时含有Fe2+和Fe3+,若要确定其中Fe2+的存在,
A、由于有Fe3+的干扰,所以无法用KSCN溶液和氯水检验Fe2+的存在,故A错误;
B、铁粉和KSCN 溶液,只能检验Fe3+的存在,而不能检验Fe2+的存在,故B错误;
C、由于有Fe3+的干扰,浓氨水无法检验Fe2+的存在,故C错误;
D、Fe2+具有还原性,能使高锰酸钾溶液褪色,故D正确;
故选D.
点评:本题考查无机物的推断,明确红棕色物质B为氧化铁及A+B→D+C为铝热反应是解答本题的关键,题目难度不大,注意试剂②不一定为NaOH.

练习册系列答案
相关题目
对于同质量的SO2和SO3,下列说法正确的是( )
| A、硫元素的质量之比为5:4 |
| B、分子数之比为1:1 |
| C、氧原子数之比为2:3 |
| D、体积之比为5:4 |
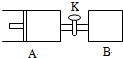 如图,向A中充入1molX、1molY,向B中充入2molX、2molY,起始时A、B的体积相等都等于aL,在相同温度和催化剂存在的条件下,关闭活塞K,使两容器中各自发生下述反应:X(g)+Y(g)?2Z(g)+W(g);△H<0.A保持恒压,B保持恒容,达平衡时,A的体积为1.4aL.下列说法错误的是( )
如图,向A中充入1molX、1molY,向B中充入2molX、2molY,起始时A、B的体积相等都等于aL,在相同温度和催化剂存在的条件下,关闭活塞K,使两容器中各自发生下述反应:X(g)+Y(g)?2Z(g)+W(g);△H<0.A保持恒压,B保持恒容,达平衡时,A的体积为1.4aL.下列说法错误的是( )| A、反应速率:v(B)>v(A) |
| B、A容器中X的转化率为80% |
| C、平衡时的压强:PB=2PA |
| D、平衡时Y的体积分数:A<B |
在已处于化学平衡状态的体系中,如果下列量发生变化,其中一定能表明平衡移动的是( )
| A、反应混合物的浓度 |
| B、反应物的转化率 |
| C、正.逆反应速率 |
| D、反应混合物的压强 |
在含有FeCl3和BaCl2的酸性溶液中,通入足量的SO2后有白色沉淀生成,过滤后,向溶液中滴加KSCN溶液,无明显现象,下列叙述不正确的是( )
| A、白色沉淀不含BaSO3 |
| B、溶液的酸性减弱 |
| C、白色沉淀是BaSO4 |
| D、FeCl3全部被还原为FeCl2 |
Cu与浓硝酸发生如下反应;Cu+4HNO3═Cu﹙NO3﹚2+2NO2↑+2H2O,被63.5铜还原的硝酸的质量是( )
| A、63g | B、126g |
| C、189g | D、252g |
下列关于Fe(OH)3胶体的制备,正确的操作是( )
| A、将FeCl3溶液滴入蒸馏水中即可 |
| B、将FeCl3溶液滴入热水中,得到黄色液体即可 |
| C、将FeCl3溶液滴入沸水中,得到红褐色液体即可 |
| D、将FeCl3溶液滴入沸水中,并继续加热煮沸至生成红褐色沉淀即可 |