题目内容
6.在生产生活中,钠、镁、铝、铁等金属的单质及化合物用途十分广泛.(1)人们在蒸馒头时,如果发酵的面粉过酸时,常常会使用Na2CO3调节,请用离子方程式表示其原因CO32-+2H+=CO2↑+H2O.
(2)某些抗酸药的成分中含有Mg(OH)2,请画出镁的原子结构示意图
 .
.(3)泡沫灭火器中会用到硫酸铝与碳酸氢钠,该反应的离子方程式为Al3++3HCO3-=Al(OH)3↓+3CO2↑.
(4)铁的一种氧化物M可用作油漆颜料,与单质铝反应,应用于焊接钢轨,请写出该化学反应方程式2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3.
(5)A为短周期某元素,其单质是空气的一种成分,该元素的气态氢化物和其最高价氧化物水化物能反应生成一种离子化合物甲.甲中含有化学键的类型有离子键、共价键,写出A单质的电子式
 .
.(6)A元素能与元素铝形成一种化合物乙,乙具有良好的电绝缘性.乙能与水缓慢反应生成含A的化合物丙,丙分子中含有10个电子.写出该反应的化学方程式AlN+3H2O=Al(OH)3↓+NH3↑.
分析 (1)碳酸钠和酸反应生成盐、水以及二氧化碳;
(2)原子结构示意图书写:圆内数字为原子的质子数,符号表示电性,圆外的弧线为电子层,弧线上的数字为该层上的电子数,离圆最近的弧线表示第一层,依次向外为第二层、第三层等,据此书写镁原子的原子结构示意图;
(3)铝离子和碳酸氢根发生相互促进水解反应,生成氢氧化铝沉淀和二氧化碳气体;
(4)Fe2O3颜色为棕红色,与铝发生铝热反应生成铁和氧化铝;
(5)空气的主要成分为氧气、氮气,A为短周期某元素,其单质是空气的一种成分,该元素的气态氢化物和其最高价氧化物水化物能反应,为氨气和硝酸的反应,A为氮气,氮氮间存在三键;
(6)A元素为氮元素,化合物乙为氮化铝,氮化铝和水反应生成氢氧化铝和氨气,氨气为含有10个电子的微粒.
解答 解:(1)蒸馒头时,如果发酵的面粉过酸时,使用Na2CO3调节,碳酸钠和酸反应生成盐、水以及二氧化碳,钠盐都极易溶于水,离子反应为:CO32-+2H+=CO2↑+H2O,
故答案为:CO32-+2H+=CO2↑+H2O;
(2)镁原子的质子数为12,有3个电子层,第一电子层容纳2个电子,第二电子层容纳8个电子,最外层容纳2个电子,原子结构示意图为为 ,
,
故答案为: ;
;
(3)氯化铝溶液与碳酸氢钠溶液混合,相互促进水解生成沉淀和气体,则反应的离子方程式为Al3++3HCO3-=Al(OH)3↓+3CO2↑,
故答案为:Al3++3HCO3-=Al(OH)3↓+3CO2↑;
(4)Fe2O3颜色为棕红色,可用作油漆颜料,高温下,铝和氧化铁发生铝热反应生成铁和氧化铝,化学方程式:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3,
故答案为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3.
(5)空气的主要成分为氧气、氮气,A为短周期某元素,其单质是空气的一种成分,该元素的气态氢化物和其最高价氧化物水化物能反应,为氨气和硝酸的反应,离子化合物甲为NH4NO3,甲中的化学键类型为离子键、共价键,氮气分子中存在氮氮三键,氮原子最外层为8电子,电子式为: ,
,
故答案为:离子化合物;离子键、共价键; ;
;
(6)A元素为氮元素,Al、N组成的氮化铝具有良好电绝缘性,所以乙为AlN,能与水缓慢反应生成含N元素的化合物丙,丙分子中含有10个电子,则丙为NH3,反应为水解反应,同时生成氢氧化铝,该反应的化学方程式为:AlN+3H2O=Al(OH)3↓+NH3↑,
故答案为:AlN+3H2O=Al(OH)3↓+NH3↑.
点评 本题考查了元素化合物知识、物质结构有关知识,掌握钠、镁、铝、铁及其化合物的性质是解答关键,侧重考查学生对知识的迁移应用与分析解决问题能力,题目难度中等.

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案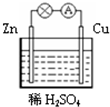
| A. | 负极反应为Cu-2e-═Cu2+ | B. | 正极反应为 Zn-2e-═Zn2+ | ||
| C. | Zn为负极,Cu为正极 | D. | 该装置能将电能转化为化学能 |
| A. | 150ml 0.2mol/L NaCl溶液 | B. | 100ml 3mol/L NH4Cl溶液 | ||
| C. | 300ml 0.1mol/L KCl溶液 | D. | 150ml 0.1mol/L FeCl3溶液 |
| A. | 64g | B. | 64 | C. | 64g/mol | D. | 32g/mol |
| A. | 苯酚沾在手上立即用酒精清洗 | B. | 误食铜盐立即喝牛奶或蛋清 | ||
| C. | 动物标本可用福尔马林浸泡防腐 | D. | 伤口处理应先用100%的乙醇消毒 |

 X、Y、Z、U、W是原子序数依次增大的前四周期元素.其中Y的原子核外有7种运动状态不同的电子;X、Z中未成对电子数均为2; U是第三周期元素形成的简单离子中半径最小的元素;W的内层电子全充满,最外层只有1个电子.请回答下列问题:
X、Y、Z、U、W是原子序数依次增大的前四周期元素.其中Y的原子核外有7种运动状态不同的电子;X、Z中未成对电子数均为2; U是第三周期元素形成的简单离子中半径最小的元素;W的内层电子全充满,最外层只有1个电子.请回答下列问题: