题目内容
12.下列叙述正确的是( )| A. | 95℃纯水的 pH<7,说明加热可导致水呈酸性 | |
| B. | pH=3的醋酸溶液,稀释至 10 倍后 pH=4 | |
| C. | pH=3的醋酸溶液,与pH=11的氢氧化钠溶液等体积混合后pH>7 | |
| D. | pH 均为3的醋酸和盐酸分别与足量Zn反应,醋酸产生的H2多 |
分析 A.加热促进水的电离,溶液中c(H+)=c(OH-);
B.醋酸为弱酸,稀释促进电离;
C.醋酸过量,反应后呈酸性;
D.醋酸为弱电解质,等pH时醋酸的物质的量多.
解答 解:A.加热促进水的电离,溶液中c(H+)=c(OH-),溶液呈中性,故A错误;
B.醋酸为弱酸,稀释促进电离,pH=3的醋酸溶液,稀释至 10 倍后 pH<4,故B错误;
C.pH=3的醋酸溶液,与pH=11的氢氧化钠溶液的浓度相等,但醋酸为弱酸,不能完全电离,醋酸过量,反应后呈酸性,故C错误;
D.醋酸为弱电解质,等pH时醋酸的物质的量多,则醋酸生成的氢气多,故D正确.
故选D.
点评 本题考查弱电解质的电离,为高频考点,侧重考查学生的分析能力,注意把握弱电解质的电离特点,易错点为A,难度中等.

练习册系列答案
相关题目
20.已知NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.2NA | |
| B. | -定条件下在密闭容器中2molSO2与2molO2充分反应,最终的气体分子数为3NA | |
| C. | 将1molNH4NO3溶于稀氨水中使溶液呈中性,溶液中NH4+数目为NA | |
| D. | 4.6g乙醇含有共价键的数目为0.9NA |
7.下列关于物质性质或检验的叙述不正确的是( )
| A. | 在溶液中加KSCN,溶液显红色,证明原溶液中一定有Fe3+,可能有Fe2+ | |
| B. | 气体通过湿润的红色石蕊试纸,试纸变蓝,证明原气体中一定含有氨气 | |
| C. | 用铂丝蘸取白色粉末灼烧,火焰成黄色,证明原粉末中一定有Na+,可能有K+ | |
| D. | 向某溶液中加盐酸产生无色气体,该气体能使澄清的石灰水变浑浊,说明该溶液中一定含有CO32-或SO32- |
17.常温下,分别取“银镜反应”(少许葡萄糖与过量银氨溶液作用)过滤后的剩余溶液,并向其中加入指定物质,反应后的溶液中主要存在的一组离子(有机物除外)正确的是( )
| A. | 通入过量的NH3(g):Ag+、NH4+、NO3-、OH- | |
| B. | 加入过量 HNO3(aq):NH4+、Ag+、H+、NO3- | |
| C. | 通入过量 HCl(g):NH4+、H+、Cl-、NO3- | |
| D. | 加入过量NaOH(aq):NH4+、Na+、NO3-、OH- |
4.下列指定反应的化学方程式或离子方程式书写正确的是( )
| A. | 乙醇和浓硫酸混合加热至140℃,CH3CH2OH$→_{140℃}^{浓硫酸}$CH2=CH2↑+H2O | |
| B. | 1-溴丙烷与氢氧化钠的乙醇溶液供热:CH3CH2CH2Br+NaOH$→_{△}^{乙醇}$CH3CH2CH2OH+NaBr | |
| C. | 苯酚钠溶液中通入少量的CO2:2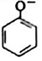 +H2O+CO2→2 +H2O+CO2→2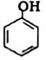 +CO${\;}_{3}^{2-}$ +CO${\;}_{3}^{2-}$ | |
| D. | 乙醛在碱性条件下被新制的氧化铜氧化:CH3CHO+2Cu(OH)2+OH-$\stackrel{△}{→}$CH3COO-+CuO↓+3H2O |
2.用NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A. | 0.5 mol O3与11.2 L O2所含的分子数一定相等 | |
| B. | 标准状况下,11.2 L由N2与CO组成的混合气体含有的原子数目为NA | |
| C. | 标准状况下,22.4 L的CCl4中含有的CCl4分子数为NA | |
| D. | 常温常压下,22.4 L的NO2和CO2混合气体含有2NA个氧原子 |
 氢氧化镍在乙醇的悬浊液中可发生如下反应生成单质镍的配合物:Ni(OH)2+5CH3NC═(CH3NC)4Ni+CH3NCO+H2O
氢氧化镍在乙醇的悬浊液中可发生如下反应生成单质镍的配合物:Ni(OH)2+5CH3NC═(CH3NC)4Ni+CH3NCO+H2O