题目内容
15.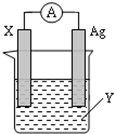 依据氧化还原反应:2Ag+(aq)+Zn(s)═Zn2+(aq)+2Ag(s) 设计的原电池如图所示.
依据氧化还原反应:2Ag+(aq)+Zn(s)═Zn2+(aq)+2Ag(s) 设计的原电池如图所示.请回答下列问题:
(1)X电极上电子流出(填“流入”或“流出”);X电极上产生的现象是锌逐渐溶解;电解质溶液Y是AgNO3(填化学式);
(2)银电极为电池的正极,发生的电极反应为Ag++e-=Ag;X电极上发生的反应类型为氧化反应;(填“氧化反应”或“还原反应”)
分析 根据反应“2Ag+(aq)+Zn(s)=Zn2+(aq)+2Ag(s)”分析,在反应中,Zn被氧化,失电子,应为原电池的负极,电极反应为Zn-2e-=Zn2+,则正极为活泼性较Zn弱的Ag,Ag+在正极上得电子被还原,电极反应为Ag++e-=Ag,电解质溶液为AgNO3 ,结合电极方程式解答该题.
解答 解:(1)由反应“2Ag+(aq)+Zn(s)=Zn2+(aq)+2Ag(s)”可知,在反应中,Zn被氧化,失电子,锌逐渐溶解,应为原电池的负极,电子从负极流出,Ag+在正极上得电子被还原,电解质溶液为AgNO3 ,
故答案为:流出;锌逐渐溶解;AgNO3;
(2)正极为活泼性较Zn弱的Ag,Ag+在正极上得电子被还原,电极反应为Ag++e-=Ag,X为负极,发生氧化反应,反应式为:Zn-2e-=Zn2+;
故答案为:正; Ag++e-=Ag; 氧化反应.
点评 本题考查原电池的设计及工作原理,注意电极反应式的书写方法,牢固掌握原电池中电极的判断,电极反应式的书写的方法性问题.

练习册系列答案
相关题目
10.设NA为阿佛加德罗常数.下列说法正确的是( )
| A. | 1mol羟基和lmol氢氧根离子所含的电子数均为10NA | |
| B. | 0.lmol/L乙酸溶液中所含醋酸根离子的数目小于0.1NA | |
| C. | 当合成氨反应达到平衡时,表明每生成6NA个N-H键的同时必生成3NA个H-H键 | |
| D. | 46g由NO2和N2O4组成的混合气体中所含的原子数为3NA |
20.下列变化属于吸热反应的是( )
①液态水汽化 ②将胆矾加热变为白色粉末 ③氯酸钾分解制氧气
④浓硫酸稀释 ⑤生石灰跟水反应生成熟石灰 ⑥Ba(OH)2•8H2O与NH4Cl晶体混合.
①液态水汽化 ②将胆矾加热变为白色粉末 ③氯酸钾分解制氧气
④浓硫酸稀释 ⑤生石灰跟水反应生成熟石灰 ⑥Ba(OH)2•8H2O与NH4Cl晶体混合.
| A. | ①③⑤ | B. | ①②③ | C. | ①②③⑥ | D. | ②③⑥ |
7.在两个恒温、恒容的密闭容器中进行下列两个可逆反应:(甲)2X(g)?Y(g)+Z(s);(乙)A(s)+2B(g)?C(g)+D(g),当下列物理量不再发生变化时,可以表明甲和乙均达到平衡状态的是( )
①混合气体密度 ②反应容器中生成物的百分含量 ③反应物的消耗速率与生成物的消耗速率之比等于化学计量数之比 ④混合气体的压强 ⑤混合气体的平均相对分子质量 ⑥混合气体的总物质的量.
①混合气体密度 ②反应容器中生成物的百分含量 ③反应物的消耗速率与生成物的消耗速率之比等于化学计量数之比 ④混合气体的压强 ⑤混合气体的平均相对分子质量 ⑥混合气体的总物质的量.
| A. | ①②③④⑤⑥ | B. | ①②③⑤ | C. | ①②③ | D. | ②③⑥ |
4.研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl═Na2Mn5O10+2AgCl,下列“水”电池在海水中放电时的有关说法正确的是( )
| A. | 负极反应式:Ag-e-═Ag+ | |
| B. | 每生成1mol Na2Mn5O10,MnO2在正极得到2mol电子 | |
| C. | Na+不断向“水”电池的负极移动 | |
| D. | AgCl是还原产物 |
 zC(g)平衡时侧得A的浓度为0.50mol/L,保持温度不变,将容器的体积扩大两倍,测得A的浓度变为0.3mol/L,下列有关判断正确的是
zC(g)平衡时侧得A的浓度为0.50mol/L,保持温度不变,将容器的体积扩大两倍,测得A的浓度变为0.3mol/L,下列有关判断正确的是