题目内容
7.在两个恒温、恒容的密闭容器中进行下列两个可逆反应:(甲)2X(g)?Y(g)+Z(s);(乙)A(s)+2B(g)?C(g)+D(g),当下列物理量不再发生变化时,可以表明甲和乙均达到平衡状态的是( )①混合气体密度 ②反应容器中生成物的百分含量 ③反应物的消耗速率与生成物的消耗速率之比等于化学计量数之比 ④混合气体的压强 ⑤混合气体的平均相对分子质量 ⑥混合气体的总物质的量.
| A. | ①②③④⑤⑥ | B. | ①②③⑤ | C. | ①②③ | D. | ②③⑥ |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:①混合气体密度,说明气体的质量不变反应达平衡状态,表明甲和乙均达到平衡状态,故正确;
②反应容器中生成物的百分含量,说明各组分的物质的量不变反应达平衡状态,表明甲和乙均达到平衡状态,故正确;
③反应物的消耗速率与生成物的消耗速率之比等于化学计量数之比,说明正逆反应速率相等,表明甲和乙均达到平衡状态,故正确;
④乙两边气体计量数相等,混合气体的压强始终不变,不能说明反应达平衡状态,故错误;
⑤混合气体的平均相对分子质量,说明气体的总质量不变,表明甲和乙均达到平衡状态,故正确;
⑥乙两边气体计量数相等,混合气体的总物质的量不变,不能说明乙达平衡状态,故错误;
故选B.
点评 本题考查了化学平衡状态的判断,难度不大,注意④中乙两边气体计量数相等,混合气体的压强始终不变,不能作平衡状态的标志.

练习册系列答案
相关题目
2.已知:HCN(aq)与NaOH(aq)反应的△H=-12.1kJ•mol-1;HCl(aq)与NaOH(aq)反应的△H=-57.3kJ•mol-1,则HCN在水溶液中电离的△H等于( )
| A. | +45.2 kJ•mol-1 | B. | -45.2 kJ•mol-1 | C. | -69.4 kJ•mol-1 | D. | +69.4 kJ•mol-1 |
12.下列实验能获得成功的是( )
| A. | 苯、溴水、铁粉混合制成溴苯 | |
| B. | 甲烷与氯气光照制得纯净的一氯甲烷 | |
| C. | 用高锰酸钾溶液除去乙烷中的乙烯杂质 | |
| D. | 可以采取蒸馏的方法,分离苯和硝基苯 |
19.已知:H2O(g)═H2O(l)△H1=-Q1 kJ/mol
C2H5OH(g)═C2H5OH(l)△H2=-Q2 kJ/mol
C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g)△H3=-Q3 kJ/mol
若使23g酒精液体完全燃烧,最后恢复到室温,则放出的热量是多少( )kJ.
C2H5OH(g)═C2H5OH(l)△H2=-Q2 kJ/mol
C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g)△H3=-Q3 kJ/mol
若使23g酒精液体完全燃烧,最后恢复到室温,则放出的热量是多少( )kJ.
| A. | 0.5Q2-1.5Q1-0.5Q3 | B. | 0.5(Q1+Q2+Q3) | ||
| C. | 0.5 Q1-1.5 Q2+0.5Q3 | D. | 1.5Q1-0.5Q2+0.5Q3 |
16.2008年北京奥运会“祥云”火炬用的是环保型燃料--丙烷(C3H8),悉尼奥运会火炬所用燃料为65%丁烷(C4H10)和35%丙烷,下列有关说法正确的是( )
| A. | 丁烷的一氯代物有5种 | B. | 丙烷分子中所有原子共平面 | ||
| C. | 符合通式CnH2n+2的均属于烷烃 | D. | 以上说法均不正确 |
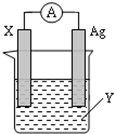 依据氧化还原反应:2Ag+(aq)+Zn(s)═Zn2+(aq)+2Ag(s) 设计的原电池如图所示.
依据氧化还原反应:2Ag+(aq)+Zn(s)═Zn2+(aq)+2Ag(s) 设计的原电池如图所示.