题目内容
10.设NA为阿佛加德罗常数.下列说法正确的是( )| A. | 1mol羟基和lmol氢氧根离子所含的电子数均为10NA | |
| B. | 0.lmol/L乙酸溶液中所含醋酸根离子的数目小于0.1NA | |
| C. | 当合成氨反应达到平衡时,表明每生成6NA个N-H键的同时必生成3NA个H-H键 | |
| D. | 46g由NO2和N2O4组成的混合气体中所含的原子数为3NA |
分析 A.羟基中含有9个电子,氢氧根离子中含有10个电子;
B.醋酸溶液体积不知,不能判断离子数;
C.化学平衡标志是正逆反应速率相同,各组分含量保持不变;
D.NO2和N2O4中N和O原子比值都为1:2,则46g NO2和N2O4的混合气体中原子数,只需计算46gNO2中原子数;
解答 解:A.羟基是中性原子团,1mol羟基中含有9mol电子,氢氧根离子是阴离子,1mol氢氧根离子中含有10mol电子,二者含有的电子数不同,故A错误;
B.溶液体积不知,0.lmol/L乙酸溶液中所含醋酸根离子的数目,不能判断,故B错误;
C.依据反应N2+3H2?2NH3分析,反应达到平衡时,每生成6NA个N-H键的同时必生成3NA个H-H键,是每生成2molNH3分子,同时生成3molH2,说明正逆反应速率相同,反应达到平衡状态,故C正确;
D.46g由NO2和N2O4组成的混合气体中所含的原子数=$\frac{46g}{46g/mol}$×3×NA=3NA ,故D正确;
故选CD.
点评 本题考查物质的量的相关计算,侧重于学生的分析能力和计算能力的考查,为高频考点,注意把握相关计算公式的运用以及物质的构成,难度不大.

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
2.已知:HCN(aq)与NaOH(aq)反应的△H=-12.1kJ•mol-1;HCl(aq)与NaOH(aq)反应的△H=-57.3kJ•mol-1,则HCN在水溶液中电离的△H等于( )
| A. | +45.2 kJ•mol-1 | B. | -45.2 kJ•mol-1 | C. | -69.4 kJ•mol-1 | D. | +69.4 kJ•mol-1 |
19.已知:H2O(g)═H2O(l)△H1=-Q1 kJ/mol
C2H5OH(g)═C2H5OH(l)△H2=-Q2 kJ/mol
C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g)△H3=-Q3 kJ/mol
若使23g酒精液体完全燃烧,最后恢复到室温,则放出的热量是多少( )kJ.
C2H5OH(g)═C2H5OH(l)△H2=-Q2 kJ/mol
C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g)△H3=-Q3 kJ/mol
若使23g酒精液体完全燃烧,最后恢复到室温,则放出的热量是多少( )kJ.
| A. | 0.5Q2-1.5Q1-0.5Q3 | B. | 0.5(Q1+Q2+Q3) | ||
| C. | 0.5 Q1-1.5 Q2+0.5Q3 | D. | 1.5Q1-0.5Q2+0.5Q3 |
 .
.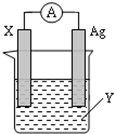 依据氧化还原反应:2Ag+(aq)+Zn(s)═Zn2+(aq)+2Ag(s) 设计的原电池如图所示.
依据氧化还原反应:2Ag+(aq)+Zn(s)═Zn2+(aq)+2Ag(s) 设计的原电池如图所示.