题目内容
1.某研究性学习小组在网上收集到信息:钠、镁等活泼金属都能在CO2气体中燃烧.他们对钠在CO2气体中燃烧后得到的白色产物进行了如下探究:
[实验操作]将燃烧的钠迅速伸入装满CO2的集气瓶中,钠在其中继续燃烧,反应后冷却,瓶底有黑色颗粒,瓶壁上附着白色物质.
[提出假设]
假设1:白色物质是Na2O.
假设2:白色物质是Na2CO3.
假设3:白色物质是Na2O和Na2CO3的混合物.
[设计方案]该小组对燃烧后生成的白色物质进行如下探究:
| 实验方案 | 实验操作 | 实验现象 | 结论 |
| 方案1 | 取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液 | 溶液变成红色 | 白色物质为Na2O |
| 方案2 | ①取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的CaCl2溶液. ②静置片刻,取上层清液于试管中,滴加无色酚酞试液 | ①出现白色沉淀. ②无明显现象 | 白色物质为Na2CO3 |
(1)写出金属镁与二氧化碳反应的化学方程式:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C.
(2)甲同学认为方案1得到的结论不正确,其理由是因为碳酸钠水解生成的氢氧化钠使溶液呈碱性,也能使酚酞试液变红色.
(3)钠在二氧化碳中燃烧的化学方程式为4Na+3CO2$\frac{\underline{\;点燃\;}}{\;}$2Na2CO3+C.
(4)乙同学认为白色物质有可能是氢氧化钠.你是否同意乙同学的观点,并简述理由:不同意,反应物是钠和二氧化碳,仅三种元素,没有氢元素.
分析 (1)Mg与二氧化碳反应生成MgO和C;
(2)加入无色酚酞试液,溶液变红,可知溶液显碱性;
(3)钠在二氧化碳中,瓶底有黑色颗粒为C,瓶壁上附着白色物质,由实验可知为碳酸钠,则燃烧生成碳酸钠和C;
(4)结合元素守恒可知,反应前后没有H元素.
解答 解:(1)Mg与二氧化碳反应生成MgO和C,反应为2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C,故答案为:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C;
(2)甲同学认为方案1得到的结论不正确,其理由是因为碳酸钠水解生成的氢氧化钠使溶液呈碱性,也能使酚酞试液变红色,
故答案为:因为碳酸钠水解生成的氢氧化钠使溶液呈碱性,也能使酚酞试液变红色;
(3)钠在二氧化碳中,瓶底有黑色颗粒为C,瓶壁上附着白色物质,由实验可知为碳酸钠,则燃烧生成碳酸钠和C,反应为4Na+3CO2$\frac{\underline{\;点燃\;}}{\;}$2Na2CO3+C,
故答案为:4Na+3CO2$\frac{\underline{\;点燃\;}}{\;}$2Na2CO3+C;
(4)由质量守恒定律可知,反应物是钠和二氧化碳,仅三种元素,没有氢元素,则结论不同意,故答案为:不同意,反应物是钠和二氧化碳,仅三种元素,没有氢元素.
点评 本题考查物质的鉴别及检验,为高频考点,把握物质的性质、发生的反应及实验现象与结论为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目
12.浓度均为0.1mol•L-1的下列溶液,其pH由小到大的排列顺序是( )
①NaHCO3溶液 ②NaHSO4溶液 ③NaCl溶液 ④AlCl3溶液 ⑤NaClO溶液.
①NaHCO3溶液 ②NaHSO4溶液 ③NaCl溶液 ④AlCl3溶液 ⑤NaClO溶液.
| A. | ①<②<③<④<⑤ | B. | ④<②<①<③<⑤ | C. | ②<④<③<①<⑤ | D. | ②<④<①<③<⑤ |
10.下列氧化还原反应中,水作为氧化剂的是( )
| A. | 2Na2O2+2H2O═4NaOH+O2↑ | B. | 3NO2+H2O═2HNO3+NO | ||
| C. | CO+H2O$\frac{\underline{\;高温\;}}{\;}$CO2+H2 | D. | 2F2+2H2O═4HF+O2 |
 E的氢化物的电子式
E的氢化物的电子式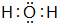 .
.
 .
. .
. .
. 合成D 的路线流程图(其他原料任选)合成
合成D 的路线流程图(其他原料任选)合成
 碱式碳酸铜是一种具有广泛用途的化工产品,主要用于固体荧光粉激活剂和铜盐的制造等.
碱式碳酸铜是一种具有广泛用途的化工产品,主要用于固体荧光粉激活剂和铜盐的制造等.